ОСНОВНЫЕ ТИПЫИ МЕХАНИЗМЫРЕАКЦИЙ
В ОРГАНИЧЕСКОЙ ХИМИИ
Методические указания для самостоятельной работы студентов 1-го курса по биологической и биоорганической химии
(модуль 1)
Утверждено
Учёным советом университета
Прот. №10 от 21 ноября 2013 г.
Харьков ХНМУ
Основные типы и механизмы реакций в органической химии: Метод. указ. для студентов 1-го курса / сост. А.О. Сыровая, Л.Г. Шаповал, В.Н. Петюнина, Е.Р. Грабовецкая, В.А. Макаров, С.В. Андреева, С.А. Наконечная, Л.В. Лукьянова, Р.О. Бачинский, С.Н. Козуб, Т.С. Тишакова, О.Л. Левашова, Н.В. Копотева, Н.Н. Чаленко. – Харьков: ХНМУ, 2014. – С. 32.
Составители:
А.О. Сыровая,
Л.Г. Шаповал,
В.Н. Петюнина,
Е.Р. Грабовецкая,
В.А. Макаров,
С.В. Андреева,
Л.В. Лукьянова,
С.А. Наконечная,
Р.О. Бачинский,
С.Н. Козуб,
Т.С. Тишакова,
О.Л. Левашова,
Н.В. Копотева,
Н.Н. Чаленко
Тема I: КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ.
РЕАКЦИОННАЯ СПОСОБНОСТЬ АЛКАНОВ, АЛКЕНОВ, АРЕНОВ, СПИРТОВ, ФЕНОЛОВ, АМИНОВ, АЛЬДЕГИДОВ, КЕТОНОВ И КАРБОНОВЫХ КИСЛОТ
Мотивационная характеристика темы
Изучение данной темы является основой для понимания некоторых биохимических реакций, которые имеют место в процессе обмена веществ в организме (пероксидное окисление липидов, образование гидроксикислот из ненасыщенных в цикле Кребса и др.), а также для понимания механизма подобных реакций при синтезе врачебных препаратов и аналогов естественных соединений.
Учебная цель
Уметь прогнозировать способность основных классов органических соединений вступать в реакции гомолитического и гетеролитического взаимодействия согласно их электронному строению и электронным эффектам заместителей.
1. СВОБОДНО-РАДИКАЛЬНЫЕ И ЕЛЕКТРОФИЛЬНЫЕ РЕАКЦИИ (РЕАКЦИОННАЯ СПОСОБНОСТЬ УГЛЕВОДОРОДОВ)
Учебно-целевые вопросы
1. Уметь описать механизмы следующих реакций:
- радикального замещения - RS
- электрофильного присоединения - AE
- электрофильного замещения - SE
2. Уметь объяснить влияние заместителей на реакционную способность при електрофильних взаимодействиях исходя из электронных эффектов.
Исходный уровень
1. Строение атома углерода. Типы гибридизации его электронных орбиталей.
2. Строение, длина и энергия s- и p- связей.
3. Конформации циклогексана.
4. Сопряжение. Открытые и закрытые (ароматические) сопряженные системы.
5. Электронные эффекты заместителей.
6. Переходное состояние. Электронное строение карбкатиона. Интермедиаторы s- и p - комплексы.
Практические навыки
1. Научиться определять возможность разрыва ковалентной связи, тип и механизм реакции.
2. Уметь экспериментально выполнять реакции бромирования соединений с двойными связями и ароматических соединений.
Контрольные вопросы
1. Приведите механизм реакции гидрирования этилена.
2. Опишите механизм реакции гидратации пропеновой кислоты. Объясните роль кислотного катализа.
3. Напишите уравнение реакции нитрирования толуола (метилбензола). По какому механизму протекает эта реакция?
4. Объясните дезактивирующее и ориентирующее влияние нитрогруппы в молекуле нитробензола на примере реакции бромирования.
Учебные задачи и алгоритмы их решения
Задача №1. Опишите механизм реакции бромирования изобутана и циклопентана при облучении светом.
Алгоритм решения. Молекулы изобутана и циклопентана состоят из sp3 гибридизованих атомов углерода. С - С связи в их молекулах неполярные, а связи С – Н малополярные. Эти связи достаточно легко подвергаются гомолитичному разрыву с образованием свободных радикалов - частичек, которые имеют неспаренные электроны. Таким образом, в молекулах этих веществ должна протекать реакция радикального замещения - RS-реакция или цепная.
Стадиями любой RS -реакции есть: инициирование, рост и обрыв цепи.
Инициирование - это процесс образования свободных радикалов при высокой температуре или облучении ультрафиолетом:

Рост цепи происходит за счет взаимодействия высокореакционноспособного свободного радикала × Br с малополярной С - Н связью в молекуле циклопентана с образованием нового циклопентил-радикала:

Циклопентил-радикал взаимодействует с новой молекулой брома, вызывая в ней гомолитический разрыв связи и образуя бромоциклопентан и новый радикал брома:

Свободный радикал брома атакует новую молекулу циклопентана. Таким образом, стадия роста цепи повторяется многократно, т.е., происходит цепная реакция. Обрыв цепи завершает цепную реакцию за счет соединения разных радикалов:

Поскольку все углеродные атомы в молекуле циклопентана равноценные, образуется только моноциклобромпентан.
В изобутане С - Н связи не являются равноценными. Они отличаются энергией гомолитической диссоциации и стабильностью образованных свободных радикалов. Известно, что энергия разрыва С - Н связи увеличивается от третичного до первичного углеродного атома. Стабильность же свободных радикалов в таком же порядке уменьшается. Именно поэтому в молекуле изобутана реакция бромирования протекает региоселективно - по третичному атому углерода:
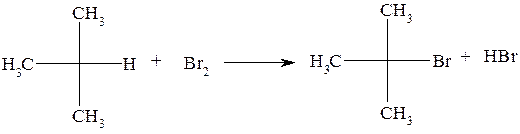
Надо указать, что для более активного радикала хлора региоселективность не придерживается в полной мере. При хлорировании замещению могут подлежать атомы водорода при любых атомах углерода, но содержимое продукта замещения при третичном углероде будет наибольшим.
Задача №2. На примере олеиновой кислоты опишите механизм реакции пероксидного окисления липидов, которые имеет место при лучевой болезни в результате повреждения клеточных мембран. Какие вещества выполняют роль антиоксидантов в нашем организме?
Алгоритм решения. Примером радикальной реакции есть пероксидное окисления липидов, при котором действия радикалов подвергаются ненасыщенные жирные кислоты, которые входят в состав клеточных мембран. При радиоактивном облучении возможный распад на радикалы молекул воды. Гидроксильные радикалы атакуют молекулу ненасыщенной кислоты по метиленовой группе, соседней с двойной связью. При этом образуется радикал, стабилизированный за счет участия неспаренного электрона в сопряжении с электронами p-связей. Далее органический радикал взаимодействует с бирадикальной молекулой кислорода с образованием нестабильных гидропероксидов, которые распадаются с образованием альдегидов, которые окисляются до кислот - конечные продукты реакции. Следствием пероксидного окиснення является разрушение клеточных мембран:
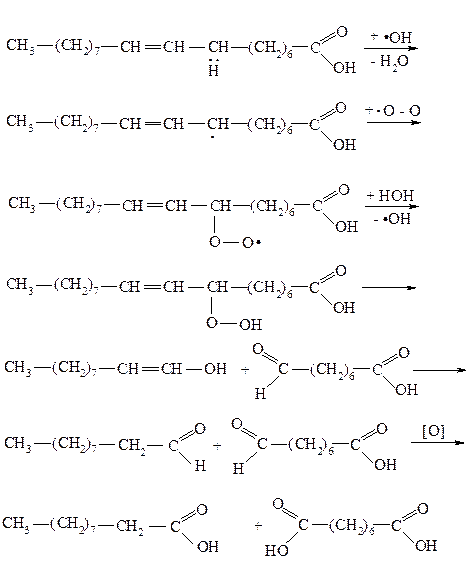
Ингибирующее действие витамина Е (токоферола) в организме обусловлено его способностью связывать свободные радикалы, которые образуются в клетках:
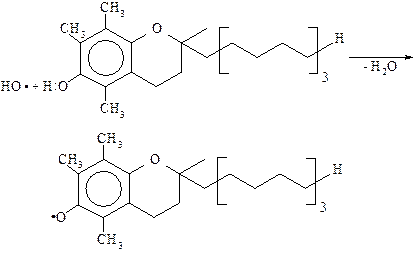
В феноксидном радикале, который образовался, неспаренный электрон находится в сопряжении с p-электронным облаком ароматического кольца, которое приводит к его относительной стабильности.
Задача №3. Приведите механизм реакции бромирования этилена.
Алгоритм решения. Для соединений, которые состоят из атомов углерода в состоянии sp2- или sp-гибридизации, типичными есть реакции, которые проходят с разрывом p-связей, т.е., реакции присоединения. Эти реакции могут протекать по радикальному или ионному механизму в зависимости от природы реагента, полярности растворителя, температуры, и т.п.. Ионные реакции протекают под действием или электрофильных реагентов, которые имеют сродство к электрону, или нуклеофильных, которые отдают свои электроны. Электрофильными реагентами могут быть катионы и соединения, которые имеют атомы с незаполненными электронными оболочками. Простейший электрофильный реагент - протон. Нуклеофильные реагенты - это анионы, или соединения с атомами, которые имеют неразделенные электронные пары.
Для алкенов - соединений, которые имеют sp2 - или sp-гибридизованный атом углерода, типичными есть реакции электрофильного присоединения - АЕ реакции. В полярных растворителях в отсутствии солнечного света реакция галогенирования протекает по ионному механизму с образованием карбкатионов:
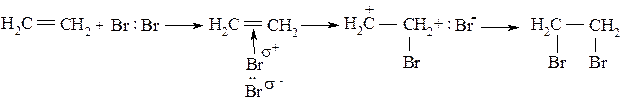
Под действием π-связи в этилене молекула брома поляризуется с образованием неустойчивого π-комплекса, который превращается в карбкатион. В нем бром связан с углеродом π-связью. Процесс завершается взаимодействием аниона брома с этим карбкатионом к конечному продукту реакции – дибромоэтана.
Задача №4. На примере реакции гидратации пропена обоснуйте правило Марковникова.
Алгоритм решения. Поскольку молекула воды - нуклеофильный реагент, то ее присоединение по двойной связи без катализатора невозможно. Роль катализаторов в таких реакциях выполняют кислоты. Образование карбкатионов происходит при присоединении протона кислоты при разрыве π-связи:
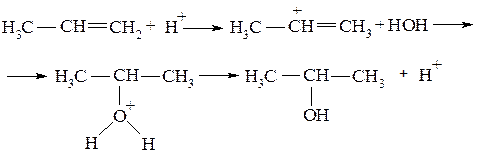
К карбкатиону, который образовался, присоединяется молекула воды за счет спаренных электронов атома кислорода. Образуется стойкое алкильное производное оксония, которое стабилизируется с выделением протона. Продукт реакции вторпропанол (пропан-2-ол).
В реакции гидратации протон присоединяется согласно правилу Марковникова - к более гидрогенизированному атому углерода, поскольку, вследствие положительного индуктивного эффекта СН3 группы именно к этому атому смещена электронная плотность. Кроме того, образованный вследствие присоединения протона третичный карбкатион более стабильный, чем первичный (влияние двух алкильных групп).
Задача № 5. Обоснуйте возможность образования 1,3-дибромопропана при бромировании циклопропана.
Алгоритм решения. Молекулы, которые представляют собой трех или четырехчленные циклы (циклопропан и циклобутан) проявляют свойства ненасыщенных соединений, поскольку электронное состояние их "банановых" связей напоминает π-связь. Поэтому подобно ненасыщенным соединениям они вступают в реакции присоединения с разрывом цикла:
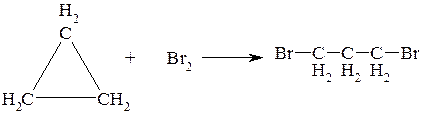
Задача № 6. Опишите реакцию взаимодействия бромоводорода с бутадиеном-1,3. В чем особенность этой реакции?
Алгоритм решения. При взаимодействии бромоводорода с бутадиеном-1,3 образуются продукты 1,2 присоединение (1) и 1,4 присоединение (2):

Образование продукта (2) обусловлено наличием в сопряженной системе общей для всей молекулы π-электронного облака, вследствие чего она вступает в реакцию электрофильного присоединения (АЕ- реакцию) в виде целого блока:
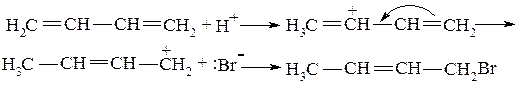
Задача № 7. Опишите механизм реакции бромирования бензола.
Алгоритм решения. Для ароматических соединений, которые содержат замкнутую сопряженно - электронную систему и которые имеют вследствие этого значительную прочность, характерны реакции электрофильного замещения. Наличие повышенной электронной плотности по обе стороны кольца защищают его от атаки нуклеофильными реагентами и наоборот - облегчают возможность атаки катионами и другими электрофильными реагентами.
Взаимодействие бензола с галогенами происходит в присутствии катализаторов - AlCl3, FeCl3 (так называемых кислот Льюиса). Они вызывают поляризацию молекулы галогена, после чего она атакует π-электроны бензольного кольца:
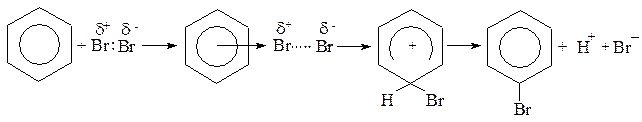
π-комплекс σ-комплекс
В начале образуется π- комплекс, который медленно переходит в σ - комплекс, в котором бром образует ковалентную связь с одним из атомов углерода за счет двух из шести электронов ароматического кольца. Четыре π-электроны, которые остались, равномерно распределенные между пятью атомами углеродного кольца; σ-комплекс является менее выгодной структурой вследствие нарушения ароматичности, которая восстанавливается путем выброса протона.
К реакциям электрофильного замещения в ароматических соединениях относятся также сульфирование и нитрирование. Роль нитрирующего агента выполняет нитроил-катион - NO2+, который образуется при взаимодействии концентрированной серной и азотной кислот (нитрирующая смесь); а роль сульфирующего агента - катион SO3H+, или оксид серы (ІV), если сульфирование ведут олеумом.
Задача № 8. Оцените реакционную способность бензола, анилина, нитробензола, пиррола и пиридина в реакциях электрофильного замещения (SE-реакциях).
Алгоритм решения. Активность соединений в SE-реакциях зависит от величины электронной плотности в ароматическом ядре (зависимость прямая). В связи с этим реакционная способность веществ должна рассматриваться во взаимосвязи с электронными эффектами заместителей и гетероатомов.
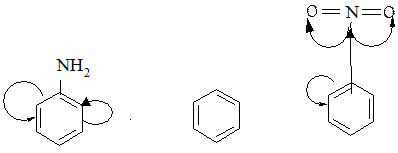
Аминогруппа в анилине проявляет +М эффект, вследствие чего в бензольном ядре электронная плотность увеличивается и наибольшая ее концентрация наблюдается в орто- и пара-положениях. Протекание реакции облегчается.
Нитрогруппа в нитробензоле имеет -І и -М эффекты, поэтому дезактивирует бензольное кольцо и именно в орто- и парах-положениях. Поскольку взаимодействие электрофила происходит в месте высочайшей электронной плотности, то в этом случае образуются мета-изомеры. Таким образом, электродонорные заместители - это орто- и пара-ориентанты (ориентанты І рода и активаторы SE-реакций; электроноакцепторные заместители - мета-ориентанты (ориентанты ІІ рода) дезактиваторы SE-реакций).
В пятичленных гетероциклах (пиррол, фуран, тиофен), которые относятся к π-избыточным системам, SE-реакции протекают легче, чем в бензоле; при этом более реакционноспособным является α-положение.
Гетероциклические системы с пиридиновым атомом азота являются π -недостаточными, поэтому тяжелее вступают в реакции электрофильного замещения; при этом электрофил занимает β-положение по отношению к атому азота.
Вопросы и упражнения
№1
1. Какой продукт получается в результате бромирования 2-метилбутана при облучении ультрафиолетом? Опишите механизм реакции.
2. Опишите механизм реакции взаимодействия бутена-1 с бромоводородом. К какому типу относится эта реакция?
3. Напишите уравнение реакции бромирования анилина (аминобензола). Покажите ориентирующее влияние аминогруппы. Что легче бромируется - бензол или анилин? Почему?
№2
1. Опишите механизм реакции хлорирования 2-метилпропана при облучении Уф-светом.
2. Приведите механизм реакции взаимодействия бутадиена-1,3 с бромоводородом.
3. Напишите уравнение реакции нитрирования бензойной кислоты с учетом ориентирующего влияния карбоксила. Что легче нитрируется - бензол или бензойная кислота? Почему?
№3
1. Приведите механизм реакции хлорирования циклогексана. Изобразите преобладающую конформацию хлорциклогексана.
2. Приведите механизм реакции присоединения HCl к акриловой (пропеновой) кислоты. Объясните, почему присоединение происходит против правила Марковникова.
3. Напишите уравнение реакции бромирования пиридина с учетом ориентировочного действия гетероатома. Какое соединение (бензол или пиридин) бромируется легче? Почему?
№4
1. Какое соединение образуется при хлорировании толуола (метилбензола) при облучении Уф-светом? Опишите механизм данной реакции.
2. Приведите механизм реакции хлорирования бутендиовой кислоты.
3. Напишите уравнение реакции нитрирования фенола с учетом ориентирующего действия гидроксила. Что легче нитрируется - бензол или фенол? Почему?
№5
1. Приведите механизм реакции бромирования пропана. Объясните, где находится C-H связь и почему в данном случае является местом атаки свободного радикала.
2. Опишите механизм реакции взаимодействия пропена с водой. Какая роль серной кислоты в данном процессе.
3. Приведите уравнение реакции бромирования бензойного альдегида. Сравните эту реакцию с реакцией бромирования бензола.
№6
1. Приведите механизм реакции бромирования циклопентана.
2. Опишите механизм реакции взаимодействия изопрена (метилбутадиена-1,3) с одним молем брома.
3. Приведите уравнение реакции нитрирования толуола (метилбензола) с учетом ориентирующего действия метильной группы. Облегчает или затрудняет реакцию нитрирования группа CH3?
№7
1. Напишите уравнение реакции бромирования циклопропана. Объясните направление реакции.
2. Обоснуйте правило Марковникова на примере реакции гидрохлорирования 2- метилпропена. Опишите механизм реакции.
3. Приведите уравнение реакции бромирования пиррола. Покажите направляющее действие гетероатома.
№8
1. Какое соединение образуется при хлорировании этилбензола при облучении Уф-светом? Опишите механизм данной реакции.
2. Опишите механизм преобразования фумаровой кислоты (транс-бутендиовой) в яблочную (2-гидроксибутандиовой) в процессе обмена веществ в живых организмах на одной из стадий цикла Кребса.
3. Какие продукты образуются при хлорировании бромбензола и бензойной кислоты? Какое соединение будет активным в реакции хлорирования?
№9
1. Приведите механизм реакции бромирования изобутана при облучении Уф-светом.
2. Сравните реакционную способность винилхлорида (хлорэтена), этилена и пропена в реакциях электрофильного присоединения. Для наиболее активного из них напишите реакцию гидробромирования.
3. Опишите механизм реакции бромирования анилина с учетом направляющего действия аминогруппы. Облегчает или затрудняет ход реакции наличие аминогруппы в бензольном ядре?
№10
1. Приведите механизм реакции хлорирования циклогексана при облучении Уф-светом.
2. Приведите механизм реакции присоединения HBr к акролеину (пропеналю). Работает ли в данном случае правило Марковникова? Ответ обоснуйте.
3. Приведите механизм реакции получения фенацетина (жаропонижающего средства) путем нитрирования фенетола (этоксибензола).
№11
1. Напишите уравнение реакции взаимодействия циклобутана с хлором. Объясните направление реакции.
2. Приведите механизм реакции гидратации акриловой (пропеновой) кислоты. Роль серной кислоты в этой реакции.
3. Напишите уравнение реакции нитрирования толуола. Что легче нитрируется - бензол или толуол и почему?
№12
1. Опишите механизм реакции хлорирования 2-метилпентана при облучении Уф-светом. Наблюдается ли в этом случае региоселективность?
2. Приведите механизм реакции хлорирования пентена-1.
3. Опишите механизм реакции бромирования пиррола. Что легче бромируется пиррол или пиридин и почему?
№13
1. Какой продукт выходит в результате бромирования 3-метилпентена при облучении ультрафиолетом? Опишите механизм реакции.
2. Приведите механизм реакции взаимодействия бутадиена-1,3 с 1 молем HBr.
3. Опишите механизм реакции нитрирования метилфенилкетона при синтезе мезатону (адреномиметика).
№14
1. Какое соединение образуется при хлорировании толуола при облучении Уф-светом? Опишите механизм данной реакции.
2. Приведите механизм реакции бромирования хлорвинила (хлорэтена).
3. Напишите уравнение реакции нитрирования никотиновой кислоты (β-пиридинкарбоновой) с учетом ориентирующего действия гетероатома. Какое соединение легче бромируется - пиридин или бензол и почему?
№15
1. Приведите механизм реакции бромирования циклогексана.
2. Приведите механизм реакции гидратации 2-бутеновой кислоты в присутствии H2SO4.
3. Напишите уравнение реакции нитрирования фурфурала (фуран-2-альдегид), на основе которого синтезируются бактерицидные препараты: фурацилин, фуродонин, фуразолидон и др.
Тема II. РЕАКЦИОННАЯ СПОСОБНОСТЬ СПИРТОВ, ФЕНОЛОВ, АМИНОВ, АЛЬДЕГИДОВ, КЕТОНОВ, КАРБОНОВЫХ КИСЛОТ.
Исходный уровень
1. Электроотрицательность элементов.
2. Полярность и поляризованность связей.
3. Строение π-связи.
4. Электронные эффекты заместителей.
5. Типы реагентов. Переходное состояние. Строение карбкатиона и карбаниона. Факторы, которые влияют на их стабильность.
6. Кислотность и основность органических соединений.
Практические навыки
1. Уметь прогнозировать реакционную способность разных классов органических соединений в реакциях нуклеофильного замещения, присоединения, элиминирования.
2. Научиться получать хлористый этил, проводить реакции дегидратации спиртов, выполнять качественные реакции на ацетон.
Контрольные вопросы
1. Приведите механизмы реакций взаимодействия пропилового спирта с бромоводородом и дегидратацией пропилового спирта. Обоснуйте необходимость кислотного катализа.
2. Получите этиловый полуацеталь пропионового альдегида; имин из метиламина и уксусного альдегида; неполный и полный амид малоновой кислоты.