Приготовление рабочего раствора перманганата калия и установление нормальной концентрации
Цель работы:
научиться готовить стандартный раствор перманганата калия и определять его концентрацию и титр (по щавелевой кислоте) в растворе.
Оборудование:
раствор щавелевой кислоты, серная кислота, КМnO4, пробирки, хим. стаканы, спиртовка, оборудование для титрования, весы аналитические.
Ход работы
1. Перед выполнением работы необходимо проработать теоретический материал
2. Выполнить задания, провести опыты, полученные результаты записать
3. Ответить на вопросы
Теоретический материал
1. Прочитайтетеоретический материал, сделайте соответствующие записи с рабочей тетради.





Опыт №1. Приготовление рабочего раствора перманганата калия

Как уже было сказано, в перманганатометрии почти всегда пользуются реакцией, протекающей по уравнению:
СeqMnO4 = 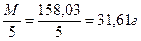
Так как, в перманганатометрии обычно применяют 0,1 н раствор, то для получения 1 литра такого раствора необходимо взять:
аКMnO4= СМV/1000=0,1x31,61x1000/1000=3,16г KMnO4
Однако перманганат калия не может быть использован в качестве исходного вещества и из его навески нельзя непосредственно приготовить титрованный раствор. Связано это с тем, что KMnO4 почти всегда загрязнен продуктами его восстановления (MnO2). С другой стороны раствор КMnO4 в течение 10-15 дней после приготовления меняет свой титр.
Поэтому приготовленный раствор перманганата калия оставляют на 10-15 дней в склянке из темного стекла, закрытой стеклянной пробкой и только по истечению этого времени фильтруют через стеклянный фильтр и определяют его нормальность. Выстоявшийся, профильтрованный и защищенный от пыли раствор КMnO4 практически не меняет своего титра в течение 4 месяцев (понижение на 0,5%).
КMnO4 действует на резину и другие органические вещества, по этой причине растворы КMnO4 следует хранить в склянках со стеклянной пробкой, а при титровании необходимо пользоваться бюретками со стеклянными кранами; растворы перманганата должны быть защищены от попадания в них пыли и действия прямых солнечных лучей. В зависимости от концентрации раствор перманганата может иметь густую окраску (1н), то нижний край мениска невиден и поэтому отсчет в бюретке производят по верхнему краю мениска. Если раствор прозрачен, работаем по нижнему мениску.
Опыт №2. Стандартизация раствора перманганата калия по щавелевой кислоте
Хорошо вымытую бюретку с краном промойте раствором перманганата калия и подготовьте к титрованию.
Ополосните пипетки раствором щавелевой кислоты и перенесите 10,00 мл его к коническую колбу. Прибавьте 8–10 мл 2Н серной кислоты, нагрейте до 70–80 (но не доводите до кипения). При этом щавелевая кислота разлагается, раствор титруйте перманганатом калия. Раствор перманганата калия приливайте медленно, по каплям, при непрерывном взбалтывании жидкости. Каждую последующую каплю добавляйте лишь после того, как обесцветилась предыдущая. В начале обесцвечивание будет проходить медленно, но затем, по мере образования сульфата марганца, играющего роль катализатора – ускоряется. Титрование прекратите, когда р-р будет бледно розовым и не исчезнет окраска в течение 1–2 минут.
Титрование повторите 2–3 раза и вычислите концентрацию и титр перманганата калия.
С(КМnO4)= V (щав. кисл.)* С (щав. кисл)/ V(КМnO4)
Т (КМnO4)= С(КМnO4)* Эквивалент (КМnO4)/1000
Результаты опыта занесите в таблицу:
| Что делали | Что наблюдали | Расчеты | Вывод (уравнения реакций) |
Для выполнения работы можете воспользоваться ссылками ниже:
https://scask.ru/b_book_a_chem2.php?id=93
https://poisk-ru.ru/s79677t1.html
Контрольные вопросы и задания
1. Чему равна молярная масса эквивалента щавелевой кислоты?
2. В какой среде щавелевая кислота реагирует с перманганатом калия? Запишите уравнение
3. Решите задачу: Определение содержания железа (II) в соли Мора
4. Опишите особенности приготовления, стандартизации с помощью оксалата натрия, хранения и использования стандартного раствора перманганата калия.