Е начало термодинамики
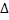 Q = dU +-
Q = dU +- 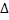 A
A
=> невозможность создания вечного двигателя первого рода
Термодинамика – это наука о тепловых явлениях. В противоположность молекулярно – кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством терм – равновесной системы является выравнивание температуры всех её частей.
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдёт в другое равновесное состояние. Такой переход называется термодинамическим процессом. Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими.
Внутренняя энергия тела – одно из важнейших понятий термодинамики. Все тела обладают энергией, заключенной внутри самих тел. Молекулярно-кинетическая теория приводит к следующему выражению для внутренне энергии одного моля идеального газа, молекулы которого совершают только поступательное движение.
U = 3/2*N Авогадро*k*T = 3/2*R*T
Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия U тела зависит наряду с температурой T также и от объема V.
U = U(T,V)
Т.О., внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния, и обладает свойством АДДетивности.
A = сумма p[i]* 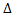 V[i]
V[i]
 A = интеграл V[1] до V[2] (p*dV).
A = интеграл V[1] до V[2] (p*dV).
 |
Обратимым процесс называется процесс, который можно провести как в одну, так и в обратную сторону. Необратимыми называются односторонние процессы.
Первый закон термодинамики.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами: 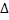 U=Q-A
U=Q-A
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Q = ∆U + A
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы над внешними силами.
Первое начало термодинамики для изопроцессов.
1. Изохорный процесс V = const. газ работы не совершает, A=0. Следовательно, Q= ∆U=U(T[2])-U(T[1])
2. Изобарный процесс (p=const) работа, совершаемая газом, выражается соотношением A = p(V[2]-V[1])=p ∆V
Q = U(T[2])-U(T[1])+p(V[2]-V[1]) = ∆U + p ∆V.
3. Изотермический процесс Q=A. Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенных над газом, превращается в тепло, которое передаётся окружающим телам.
4. Адиабатический процесс ∆Q = 0. Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствии теплообмена с окружающими телами. Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называются адиабатическими. pV^гамма=const уравнение Пуассона, где гамма=сp/cv. при cp = cv, переходит в уравнение изотермы.
Адиабатический просесс также можно отнести к изопроцессам. В термодинамике важную роль играет физическая величина, которая называется энтропия. Изменение энтропии в каком-либо квазистатическом процессе равно приведённому теплу ∆Q/T, полученному системой. поскольку на любом участке адиабатического процесса ∆Q=0, энтропия в этом процессе остаётся неизменной. Адиабатический = изэнтропический.
Адиабатный процесс является процессом квазиститическим. Все промежуточные состояния газа в этом процессе близким к состоянию термодинамического равновесия. Любая точка на адиабате описывает равновесное состояние.
Теплоёмкость. c = Q/m*∆T Молярная теплоёмкость C = M*c, где M – молярная масса вещества.
Уравнение Майера Cp = Cv + R
Термодинамические процессы, в которых теплоёмкость газа остаётся неизменной, называются политропическими. Все изопроцессы являются политропическими.
∆U = 3/2*R*∆T=Cv*∆T
Cv=3/2*R=12,47 Дж/моль*K
На каждую степень свободы приходится ½*k*T
Cv=i/2*R, Cp=Cv+R=((i+2)/2)*R