Вода. Растворы.
Вода в природе, быту, технике и на производстве.
Физические и химические свойства воды.
Опреснение воды. Агрегатные состояния воды и ее переходы из одного агрегатного состояния в другое.
Способы выражения состава раствора
Вода – это самое распространенное и самое удивительное вещество на нашей планете. Она вездесуще, нет ничего, что в своем составе, не содержало бы воды. Океан, на ¾ покрывающий нашу Землю, в котором миллиарды лет назад зародилась жизнь, – это вода. Снежные шапки горных вершин, бескрайние ледяные пустыни Арктики и Антарктики — это тоже вода. Тучи иоблака, туман и осадки, несущие влагу всему живому на планете, – и это вода.
Жизнь и вода неразделимы. Роль воды в живой природе велика и многогранна. Она определяет не только объем и упругость растительных и животных клеток, но также является средой, вкоторой протекают многочисленные химические реакции, лежащие в основе процессов обмена веществ. Вода сама участвует во многих жизненно важных реакциях, например в знакомом вам процессе фотосинтеза.
Организм взрослого человека на 3/4 состоит из воды, причем ее содержание в различных органах неодинаково. Больше всего воды в глазном яблоке. Мозг человека содержит 80 % воды,печень - 70 %, мышцы — около 60 %. И даже в костях есть вода — до 30%. Самая «безводная» часть нашего организма — эмаль зубов.
В сутки человек должен потреблять около 3 л воды. Но это не значит, что нужно обязательно выпить 15 стаканов жидкости. Вода содержится во всех продуктах питания. В хлебе ее 40 %, в мясе — 75%, в рыбе — 80%, а в овощах — более 90%. Представляете, обыкновенный огурец— это на 98 % вода!
Вода необходима не только человеку и животным. Самые заправские «водохлебы» — растения. Подсолнуху для роста необходим один литр воды в день, а взрослая береза высасывает из земли до 60 л воды за сутки!
Воду в огромных количествах используют в промышленности в качестве теплоносителя, растворителя, реагента. В металлургии для выплавки 1 т чугуна и переплавки его в сталь требуется 300 т воды, для получения 1 т меди — 500 т, а 1 т никеля — 4 000 т воды.
Может показаться, что запасы воды неисчерпаемы. Однако это не так. Водные ресурсы Земли (1 345 млн км3) составляет соленая и пресная вода, причем на долю последней приходится всего 2,8 % ее общего запаса. А теперь отнимите из этого показателя 2,5% пресной воды полярных ледников, которые еще недоступны для использования. Все чаще поступают тревожные сообщения из разных уголков планеты о нехватке пресной воды, все настойчивее звучит призыв экологов бороться с загрязнением природных водоемов.
Каждый житель крупного города на бытовые нужды должен Расходовать около 35 л воды в сутки. Однако из-за нерационального ее использования, потерь при транспортировке за счет неисправного оборудования или аварий, а то и просто по причине нашей халатности этот показатель увеличивается порой в 20 раз!
Считывая необыкновенно важную роль воды на нашей планете. Рассмотрим агрегатные состояния веществ и их взаимные переходы на примере именно этого удивительного соединения с известной каждому ребенку формулой: Н2О.
В атмосферном воздухе всегда содержится вода в газообразном состоянии. Если вы прислушивались к прогнозу погоды, то, наверняка обращали внимание на фразу типа «относительная влажность воздуха 70%». Относительная влажность воздуха показывает максимально возможное содержание в воздухе паров вод при данной температуре.
Молекулы веществ в газообразном состоянии находя настолько далеко друг от друга, что их взаимодействием можно пренебречь. Это приводит к тому, что частицы газа перемещаются по всему сосуду, в котором он находится. Следовательно, газы не имеют собственного объема и формы.
Благодаря большому расстоянию между молекулами газы смешиваются друг с другом в любых отношениях. Важнейшими при родными смесями газов являются воздух, природный и попутный нефтяной газы.
Газы легко сжимаемы. При этом расстояние между частицами уменьшается, давление газа на стенки сосуда увеличивается, форма молекул не изменяется.
Часто вместо термина «газ» применительно к воде в газообразном состоянии используют термин «пар». Пары воды прозрачны и бесцветны, их невозможно увидеть. А вот в бытовом понимании водяным паром называют мельчайшие капельки сконденсированной влаги, например туман, пар над поверхностью водоема в холодное утро, пар из носика кипящего чайника. Процесс перехода вещества из газообразного в жидкое агрегатное состояние называют конденсацией.
Частицы вещества в жидком состоянии расположены гораздо ближе друг к другу и благодаря силам взаимного притяжения молекул жидкости обладают такой важной физической характеркой, как собственный объем. Если вы попробуете сжать жидкость, то у вас ничего не получится: при попытке уменьшить расстояние между молекулами возникают силы их взаимного отталкивания, поэтому жидкие вещества практически несжимаемы. Однако,поступательное движение молекул, хотя и затруднено по сравнению с газами, все-таки сохраняется. Это обусловливает такое важнейшее свойство жидкостей, как текучесть. Поверхностное натяжение заставляет жидкие вещества принимать сферическую форму, это возможно только в невесомости или при свободном падении капли.
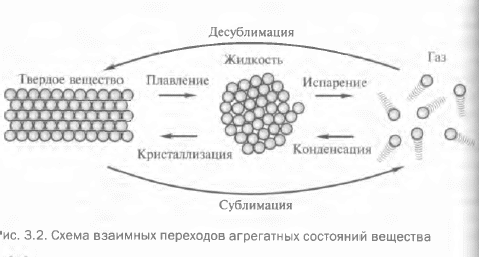
Любое жидкое вещество при охлаждении переходит в твердое агрегатное состояние. Такой процесс называют кристаллизацией. Для воды этот процесс происходит при температуре 0°С. Часто о воде говорят, как о живом существе: вода замерзает.
Вам хорошо знакомы причудливый и неповторимый узор снежинок, острые, похожие на стекло кромки ледяных осколков. Это вода в твердом агрегатном состоянии.
Частицы вещества в твердом состоянии находятся настолько близко друг к другу, что очень ограничены в движении. Они, главным образом, совершают колебания относительно положения равновесия, а вот перемещаться для них — почти неразрешимая задача. Силы взаимного притяжения частиц в твердых веществах настолько велики, что они, как правило, не обладают текучестью и имеют не только свой объем, но и форму.
Переходными свойствами от жидких веществ к твердым кристаллическим обладают необычные вещества, которые так и называют — жидкими кристаллами. Подобно жидкостям они текучи. Подобно кристаллическим веществам они обладают сравнительно упорядоченным расположением молекул.
Жидкие кристаллы весьма распространены в природе. Они входят в состав многих живых тканей, в первую очередь тех, которые помогают живым организмам ориентироваться в пространстве.
Как правило, молекулы жидких кристаллов имеют сильно вытянутую линейную форму. При различных условиях (нагревании, наложении электрического или магнитного поля) оси линейных молекул жидких кристаллов ориентируются в пространстве, оно приводит к изменению свойств вещества, например его цвета. Па этом принципе основано использование жидких кристаллов в дисплеях электронных приборов, буквенно-цифровых индикаторах электронных часов, микрокалькуляторов и т.д. В настоящее время жидкие кристаллы применяют для изготовления телевизоров с плоским экраном и мониторов компьютеров.
Еще одним «пограничным» между твердым и жидким агрегатами состояниями является аморфное состояние вещества.
Что же такое аморфные вещества? Это твердые вещества, так как они подобно кристаллическим сохраняют свою форму доя точно долго. Однако через длительный промежуток времени тела, изготовленные из аморфных веществ, все же изменяют форму это сближает последние с жидкостями. Например, парафинов: или восковая свеча, поставленная наклонно, через некоторое время изогнется. Попробуйте проделать нечто подобное с обыкновенной жевательной резинкой или кусочком пластилина. Результат будет таким же. По мере повышения температуры процесс размягчения ускоряется. Определенной температуры плавления у аморфных тел, в отличие от кристаллических, нет.
Аморфные и кристаллические вещества, являясь двумя полюсами твердого состояния вещества, тем не менее встречаются oодновременно в одном и том же веществе. Многие полимеры, представляя в целом аморфные вещества, вместе с тем обладают участками кристаллической структуры. Этим определяется, например, высокая прочность полипропиленового или капронового волокон.
Слово «аморфный» бесформенный в сознании многих несет негативный оттенок. Очевидно, это справедливо для характеритики личностных качеств человека. В мире химических веществ)! материалов все наоборот. Именно аморфные вещества являют нам в блеске драгоценного жемчуга, в медовом свечении янтаря, скромном обаянии полудрагоценных опала и халцедона, в волшебном многоцветии витражей и мозаики, в изумительной ш света хрусталя и блеске зеркальных витрин.
Аморфность — ценное качество полимеров, так как она обусловливает такое их технологическое свойство, как термопластичность, т.е. способность размягчаться и изменять форму при нагревании и застывать при охлаждении. Именно благодаря термопластичности некоторых полимеров из них можно вытянуть тончайшие нити, превратить в прозрачную пленку или отлить издД лие самой замысловатой формы.
Таким образом, аморфные вещества по своей структуре можно рассматривать как очень вязкие жидкости, а по свойствам — как твердые вещества.
2. Вода – наиболее распространенное на Земле вещество, она покрывает приблизительно четыре пятых земной поверхности. Это единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (лед) и газа (пары воды) Вода играет жизненно важную роль в промышленности, быту и в лабораторной практике; она совершенно необходима для поддержания жизни. Приблизительно две трети человеческого тела приходятся на долю воды, и многие пищевые продукты состоят преимущественно из воды.
Структура и физические свойства воды. В 1860-х годах итальянский химик Станислав Канниццаро, исследуя органические соединения, содержащие группы —ОН, названные им гидроксильными, окончательно установил, что вода имеет формулу Н2О.
Вода — ковалентное молекулярное соединение. Связь О—Н ковалентная полярная; угол 104,5°. Кислород как более электроотрицательный атом (электроотрипательность — это способность притягивать к себе общую электронную плотность при образовании связи) оттягивает на себя общую с атомом водорода электронную плотность к себе и потому несет частичный отрицательный заряд; атомы водорода, от которых электронная плотность смещена, несут частичный положительный заряд. Таким образом, молекула воды представляет собой диполь, т.е. имеет положительно и отрицательно заряженные участки. Вода представляет собой прозрачную бесцветную жидкость, обладающую целым рядом аномальных физических свойств. Например, она имеет аномально высокие температуры замерзания и кипения, а также поверхностное натяжение. Редкой особенностью воды является то. что ее плотность в жидком состоянии при 4 °С больше плотности льда. Поэтому лед плавает на поверхности воды. Эти аномальные свойства воды объясняются существованием в ней водородных связей, которые связывают между собой молекулы как в жидком, так и в твердом состоянии. Вода плохо проводит электрический ток, но становится хорошим проводником, если в ней растворены даже небольшие количества ионных веществ.
Химические свойства воды
1. Кислотно-основные реакции. Вода обладает амфотерными свойствами. Это означает, что она может выступать как в роли кислоты, так и в роли основания. Ее амфотерные свойства обусловлены способностью воды к самоионизаиии:
2Н2О (ж.) = Н3О+ (водн.) + ОН-(водн.).
Это позволяет воде быть, с одной стороны, акцептором протона:
НС1 + Н2О=. Н3О+ + С1-
а с другой стороны — донором протона:
NH3 + Н2О= NH4+ + ОН-
2. Окислительно-восстановительные реакции. Вода обладает способностью выступа как в роли окислителя, так и в роли восстановителя. Она окисляет металлы, расположенные в электрохимическом ряду напряжений выше олова. Например, в реакции между натрием и водой
2Na + 2Н2О = 2NaOH + Н2
происходит следующий окислительный процесс:
Na (тв.) = Na+(водн.) + е.
В этой реакции вода играет роль восстановителя:
2 Н2О (ж.) + 2е =20Н- (водн.) + Н2(г.).
Другим примером подобной реакции является взаимодействие между магнием и водяным паром:
Mg (тв.) + Н2О 0 (г.) = MgO (тв.) + Н2(г.).
Вода действует как окислитель в процессах коррозии. Например, один из процессов, протекающих при ржавлении железа, заключается в следующем:
2 Н2О + O2 + 4е = 4 ОН-
Вода является важным восстановителем в биохимических процессах. Например, некоторые стадии цикла лимонной кислоты включают восстановление воды:
2Н3O = О3 + 4Н+ + 4 е.
Этот процесс электронного переноса имеет также большое значение в восстановлении органических фосфатных соединений при фотосинтезе. Цикл лимонной кислоты и фотосинтез представляют собой сложные процессы, включающие ряд последовательно протекающих химических реакций. В обоих случаях процессы электронного переноса, происходящие в них, еще не полностью выяснены.
3. Гидратация. Молекулы воды способны сольватировать как катионы, так и анионы. Этот процесс называется гидратацией. Гидратная вода в кристаллах солей называется кристаллизационной водой. Молекулы воды обычно связаны с сольватируемымими катионом координационными связями. Обозначают содержание гидратной воды в формуле вещества:CuSO4 • 4Н2O.
4. Гиролиз. Гидролиз представляет собой реакцию какого-либо иона или молекулы с водой. Примером реакций этого типа может быть реакция между хлороводородом и водой с образованием соляной кислоты. Другой пример-гидролиз хлорида железа(III):
FeCl3 (води.) + ЗН2O (ж.) = Fe(OH)3 (тв.) + 3HCl (водн.).
5. Взаимодействие с оксидами активных металлов: СаО + Н2O = Са(ОН)2.
6. Взаимодействие с оксидами неметаллов: Р2O5 + Н2O = 2НРO3
Вода широко используется в качестве растворителя в химической технологии, а также в лабораторной практике. Она представляет собой универсальный растворитель, необходимый для протекания биохимических реакций. Дело в том, что вода прекрасно растворяет ионные соединения, а также многие ковалентные соединения Способность воды хорошо растворять многие вещества обусловлена полярностью ее молекул, которые при растворении в воде ионных веществ ориентируются вокруг ионов, т.е. сольватируют их. Водные растворы ионных веществ являются электролитами. Растворимость ковалентных соединений в воде зависит от их способности образовывать водородные связи с молекулами воды. Простые ковалентные соединения, как, например, диоксид серы, аммиак и хлороводород, растворяются в воде. Кислород, азот и диоксид углерода плохи растворяются в воде. Многие органические соединения, содержащие атомы электроотрицательных элементов, как, например, кислорода или азота, растворимы в воде. В качестве примера укажем этанол С2Н5ОН, уксусную кислотуCH3COOH, сахар С12Н22О6. Присутствие в воде нелетучих растворенных веществ, например хлорида натрия или сахара, понижает давление пара и температуру замерзания воды, но повышает ее температуру кипения. Присутствие в воде растворимых солей кальция и магния (жесткость воды) затрудняет ее использование в технологических процессах.
Жесткость воды подразделяется на временную (карбонатную), обусловленную присутствием гидрокарбонатов кальция Са(НСО3)2 и магния Mg (НСО3) 2) и постоянную (некарбонатную) жесткость.
Растворимость газов в воде зависит от температуры и парциального давления газа над водой: чем ниже температура и выше парциальное давление газа над водой, тем выше концентрации газа в жидкости
Растворимость большинства твердых веществ повышается при увеличении температуры. При растворении твердого вещества протекают два процесса:
1. процесс разрушения кристаллической решетки. Этот процесс требует затраты энергии, поэтому является эндотермическим;
2. процесс образования гидратов (сольватов) протекает с выделением энергии.
Общая теплота растворения складывается из теплот этих двух процессов, поэтому растворение может проходить как с повышением, так и с понижением температуры.
Раствором называется гомогенная (однородная) система, состоящая из двух или более компонентов. Необходимыми компонентами раствора являются растворитель и растворенное вещество, например, растворенный в воде сахар. В одном растворителе может находиться несколько растворенных веществ. Например, при приготовлении маринада в воде растворены сахар, соль и уксусная кислота. Растворенными веществами при одинаковом агрегатном состоянии компонентов обычно считаются компоненты, находящиеся в недостатке, в то время как компонент, находящийся в избытке, считается растворителем. При разных агрегатных состояниях компонентов раствора растворителем обычно считается компонент, агрегатное состояние которого совпадает с агрегатным состоянием раствора. Например, в случае жидких растворов твердых и газообразных веществ растворителем всегда считается жидкий компонент, независимо от концентрации растворенных веществ. Если при приготовлении раствора используют две жидкости, растворителем является та, которая находится в избытке. Если при приготовлении раствора используют воду, то растворителем является вода.
Водные ресурсы Земли
Водные ресурсы — это все волы гидросферы: т.е. воды рек. озер, каналов, водохранилищ, морей и океанов, подземные воды, почвенная влага, вода (льды) горных и полярных ледников, водяные пары атмосферы.
Общий объем (единовременный запас) водных ресурсов составляет 1390 млн км3, из них около 1340 млн км3 — воды Мирового океана. Менее 3% составляют пресные воды, из них технически доступны для использования — всего 0,3%.
Пресная вода оказывается доступной человеку в результате участия в гидрологическом иикле, или круговороте воды в природе. Ежегодно в круговорот воды в результате ее испарения и выпадения осадков в виде дождя или снега вовлекается приблизительно 500 000 км3 воды. По теоретическим подсчетам максимальное количество пресной воды, доступное для использования, составляет приблизительно 40 ООО км3 в год. Речь идет о той воде, которая стекает с поверхности земли в моря и океаны (так называемый сток).
Использование пресной воды принято подразделять на многократное использование и безвозвратное расходование. В соответствии с этим пресную воду также иногда подразделяют на используемую многократно и расходуемую безвозвратно. Многократное использование воды может быть проиллюстрировано на таких примерах, как навигация, рыбоводство и получение гидроэлектроэнергии. Безвозвратно расходуемая пресная вода становится уже недоступной для повторного использования. К ней относится пресная вода, которая после употребления оказалась потерянной в результате испарения (в том числе листьями растений); вода, вошедшая в состав продуктов, а также вода стока, достигшая моря (океана) и смешавшаяся с соленой водой. Безвозвратный расход пресной воды во всем мире составляет от 2500 до 3000 км3 в год, причем из этого количества приблизительно 10% расходуется в бытовых целях, 8*% в промышленности, а подавляющее большинство — 82% — идет на ирригацию в сельском хозяйстве.
Поскольку вода — хороший растворитель, она редко встречается в абсолютно чистом виде. Пригодность воды для питья и наполнения плавательных бассейнов зависит от ее качества. Ниже лреведены некоторые характеристики, которыми определяется качество воды
Характеристики воды:
· прозрачность;
· наличие растворенных неорганических веществ, например нитратов, хлоридов, железа;
· температура;
· наличие растворенных органических веществ, например фенолов;
· вкус;
· наличие микроорганизмов, например бактерий;
· запах;
· наличие флоры и фауны,
· pH;
· электропроводность;
· жесткость.
Загрязнение воды — это понижение ее качества в результате попадания в реки, ручьи, озера, моря и океаны различных физических, химических или биологических веществ. Степень загрязнения можно определить по наличию в воде микроорганизмов, которое определяется в результате измерения ее биохимической потребности в кислороде (БПК). С этой целью определяют содержание кислорода в воде до и после выдерживания ее в темноте в течение пяти суток при температуре 20 °С. БПК измеряется в мг/дм3.
Загрязнение воды имеет много причин
Источники загрязнения воды.
1. Населенные пункты. Наиболее известным источником загрязнения воды, коюрому традиционно уделяется главное внимание, являются бытовые (или коммунальные) сточные воды.
2. Промышленность. В индустриально развитых странах главным потребителем воды и самым крупным источником стоков является промышленность. Промышленные стоки в реки по объему в 3 раза превышают коммунально-бытовые. Более половины стоков, поступающих в водоемы, дают четыре основные отрасли промышленности: целлюлозно-бумажная, нефтеперерабатывающая, промышленноегь органического синтеза и черная металлургия (доменное и сталелитейное производства). Из-за растущего объема промышленных отходов нарушается экологическое равновесие многих озер и рек, хотя большая часть стоков нетоксична и несмертельна для человека.
3. Тепловое загрязнение. Наиболее масштабное однократное употребление воды — производство электроэнергии, где она используется главным образом для охлаждения и конденсации пара, вырабатываемого турбинами тепловых электростанций. При этом вода нагревается в среднем на 7 °С, после чего сбрасывается непосредственно в реки и озера, являясь основным источником дополнительного тепла, который называют «тепловым загрязнением». Против употребления этого термина имеются возражения, поскольку повышение температуры воды иногда приводит к благоприятным экологическим последствиям.
4. Сельское хозяйство. Вторым основным потребителем воды является сельское хозяйство, использующее ее для орошения полей. Стекающая с них вода насыщена растворами солей и почвенными частицами, а также остатками химических веществ, способствующих повышению урожайности. К ним относятся инсектициды; фунгициды, которые распыляют над фруктовыми садами и посевами; гербициды, знаменитое средство борьбы с сорняками; и прочие пестициды, а также органические и неорганические удобрения, содержащие азот, фосфор, калий и иные химические элементы. Кроме химических соединений, в реки попадает большой объем фекалий и других органических остатков с ферм, где выращиваются мясо-молочный крупный рогатый СК01, свиньи или домашняя птица. Много органических огходов также поступает в процессе переработки продукции сельского хозяйства (при разделке мясных туш, обработке кож, производстве пищевых продуктов и консервов и т.д.).