Образование двойного электрического слоя (ДЭС) происходит самопроизвольно в результате стремления системы уменьшить энергию Гиббса поверхностного слоя. Это стремление вызывает определенное ориентирование полярных молекул, ионов и электронов в поверхностном слое, в результате чего соприкасающиеся фазы приобретают заряды противоположного знака, но равной величины.
Различают три возможных механизма образования двойного электрического слоя.
1. Двойной электрический слой образуется в результате перехода ионов или электронов с поверхности твердой фазы в дисперсионную среду. Рассмотрим основные разновидности этого механизма.
Так, например, на границе металл – газ происходит термоэлектронная эмиссия: переход электронов с поверхности металла в газовую фазу, интенсивность перехода растет с ростом температуры. В результате поверхность металла заряжается положительно, а у поверхности со стороны газовой фазы концентрируется электронное облако. Возникший положительный заряд поверхности препятствует дальнейшему переходу электронов. Наступает равновесное состояние, при котором в двойном электрическом слое положительный заряд поверхности металлической частицы скомпенсирован совокупностью отрицательных зарядов электронов вблизи поверхности*.
Частица малорастворимого соединения с ионной кристаллической структурой на границе с водной фазой может поверхностно растворяться с преимущественным переходом в водную фазу тех ионов, электрохимический потенциал которых выше. Условие равновесия выражается в этом случае равенством не химических, а электрохимических потенциалов:
 (1)
(1)
 При установлении равновесия происходит переход ионов i вида из фазы с большим электрохимическим потенциалом, в фазу с меньшим электрохимическим потенциалом.
При установлении равновесия происходит переход ионов i вида из фазы с большим электрохимическим потенциалом, в фазу с меньшим электрохимическим потенциалом.
Межфазный скачок потенциала Δj = j(1) + j(2) , возникая при этом, препятствует дальнейшему переходу ионов. Состоянию равновесия отвечает равенство:
 (2)
(2)
и равновесный скачок потенциала Dj:
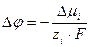 , (3)
, (3)
где Δmi = mi (т) - mi (ж) ; Δj = j(т) - j(ж).
Например, частицы иодида серебра будут терять ионы серебра, которые сильнее гидратируются, чем иодид-ионы. В результате на поверхности частиц оказывается избыточное количество иодид-ионов, которые в этом случае являются потенциалопределяющими. Вокруг отрицательно заряженных частиц иодида серебра концентрируются положительно заряженные катионы серебра – противоионы. В целом комплекс и в этом случае электронейтрален.
Заряд поверхности может создаваться при гидратации молекул поверхностного слоя частицы и последующей диссоциации продукта гидратации. Так создается заряд частиц диоксида кремния в воде. Молекулы SiO2, находящиеся в поверхностном слое частицы, взаимодействуют с молекулами воды, образуя кремневую кислоту, которая диссоциирует с переходом в раствор ионов Н+:
H2SiO3 ↔ HSiO3- + H+ ↔ SiO32- + 2H+ (4)
Силикат-ионы остаются на поверхности частиц, создавая слой потенциалопределяющих ионов, а ионы Н+ (Н3О+) образуют слой противоионов.
Частицы, состоящие из органических молекул ионогенной структуры, также способны поверхностно диссоциировать, при этом в воду переходят неорганические ионы молекул поверхностного слоя частиц. Они сильнее взаимодействуют с водой и создают слой противоионов. Заряд поверхности образован органическими ионами, остающимися на частице, и играющими роль потенциалопределяющих инов.
2. Заряд поверхности частиц может создаваться в результате адсорбции ионов из раствора. Если в растворе имеются ионы, входящие в состав кристаллической структуры, то, в соответствии с правилом Фаянса-Панета, именно эти ионы будут адсорбироваться на поверхности частиц, сообщая им соответствующий заряд. Противоположно заряженные ионы будут являться противоионами, концентрируясь вблизи заряженной поверхности.
Заряд поверхности может создаваться также в результате избирательной адсорбции ионов из растворов электролитов, не содержащих ионов, входящих в состав твердой фазы. Например, на металлах в растворе хлорида натрия, как правило, специфически адсорбируются хлорид-ионы, сообщая поверхности частицы металла отрицательный заряд. Ионы натрия будут являться противоионами, создавая с хлорид-ионами двойной электрический слой. На частицах парафина, диспергированного в слабом растворе щёлочи, заряд поверхности образуют ионы гидроксила, а ионы щелочного металла создают слой противоионов.
Большой поверхностной активностью обладают ионогенные поверхностно-активные вещества. Адсорбируясь на поверхности частиц, органические ионы, образуют заряд поверхности, а неорганические ионы сильнее взаимодействуют с водной средой, создавая слой противоионов.
3. Двойной электрический слой может создаваться и в том случае, когда поверхность образована двумя фазами, молекулы которых не способны диссоциировать, но обладают значительными дипольными моментами. Полярные молекулы, находящиеся в растворе, могут адсорбироваться на поверхности частиц, ориентируясь в поверхностном слое дисперсионной среды в соответствии с полем, создаваемым полярными молекулами твердой фазы. Согласно правилу Кёна, из двух соприкасающихся фаз, не способных обмениваться зарядами, положительно заряжается та фаза, которая имеет бóльшую диэлектрическую проницаемость. У воды диэлектрическая проницаемость очень велика (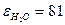 ), поэтому в воде многие поверхности заряжаются отрицательно.
), поэтому в воде многие поверхности заряжаются отрицательно.
Рассмотренные закономерности образования ДЭС говорят о тесной взаимосвязи между параметрами двойного слоя и поверхностными явлениями, особую роль среди которых играет адсорбция. Наличие заряда на межфазной поверхности изменяет свободную поверхностную энергию, которая на границе жидкость – газ или жидкость – жидкость численно равна поверхностному натяжению σ. Термодинамическое соотношение между поверхностной и электрической энергией гетерогенной системы отражает уравнение Липпмана:
η0 = –(∂σ/∂φ) T, Ρ, n, (1)
где η0 – плотность поверхностного заряда, φ –электрический потенциал заряженной поверхности. Зависимость σ - φ называется электрокапиллярной кривой. Если знаки заряда и потенциала совпадают, то поверхностное натяжение с ростом потенциала уменьшается, при разных знаках поверхностное натяжение растет, т.е. зависимость σ – φ проходит через максимум. В точке максимума η0 =0. Потенциал, при котором заряд поверхности равен нулю, носит название потенциал нулевого заряда (ПНЗ). Зависимость σ – φ выражена тем сильнее, чем больше заряд поверхности. Адсорбция ионов и ПАВ приводит к смещению ПНЗ. По этим смещениям можно оценить энергию специфической (некулоновской) адсорбции, выражаемой адсорбционным потенциалом Ф [см. уравнение (20)]. Изучение связи между σ и φ имеет большое значение для электрохимии и весьма широко используется при исследовании процессов на ртутных электродах. Уравнение Липпмана позволяет вычислить заряд поверхности η0 при любом потенциале, а также дифференциальную ёмкость двойного электрического слоя, С:
С=-dη0/dE (2)