Изомерия алкенов
Наряду со структурной изомерией углеродного скелета для алкенов характерны, во-первых, другие разновидности структурной изомерии - изомерия положения кратной связи и межклассовая изомерия.
Во-вторых, в ряду алкенов проявляется пространственная изомерия, связанная с различным положением заместителей относительно двойной связи, вокруг которой невозможно внутримолекулярное вращение.
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8):

2. Изомерия положения двойной связи (начиная с С4Н8):

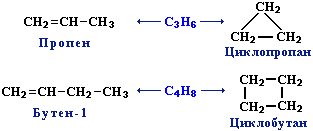
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:
Пространственная изомерия алкенов
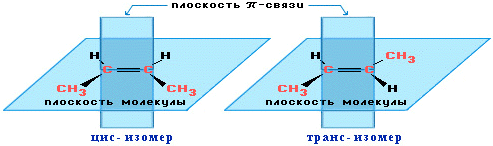
Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения p-связи (p-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис - транс -изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости n-связи. Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис -изомере, либо по разные стороны в транс -изомере.

ВНИМАНИЕ! цис-транс - Изомерия не проявляется, если хотя бы один из атомов С при двойной связи имеет 2 одинаковых заместителя.
Например, бутен-1 СН2=СН–СН2–СН3 не имеет цис - и транс -изомеров, т.к. 1-й атом С связан с двумя одинаковыми атомами Н.
Изомеры цис - и транс - отличаются не только физическими
 ,
,
но и химическими свойствами, т.к. сближение или удаление частей молекулы друг от друга в пространстве способствует или препятствует химическому взаимодействию.
Номенклатура
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен: этан — этилен, пропан — пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:

Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
(Н2С=СН—) винил или этенил
(Н2С=CН—СН2) аллил
Физические свойства
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
С2 – С4 (газы)
С5 – С17 (жидкости)
С18 – (твёрдые)
Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.) Легче воды. С увеличением Mr температуры плавления и кипения увеличиваются
Физические свойства некоторых алкенов показаны в табл. 1. Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) — газы, начиная с C5H10(амилен, или пентен-1) — жидкости, а с С18Н36 — твердые вещества. С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение. Температуры кипения цис -изомеров выше, чем транс -изомеров, а температуры плавления — наоборот.
Алкены плохо растворимы в воде (однако лучше, чем соответствующие алканы), но хорошо — в органических растворителях. Этилен и пропилен горят коптящим пламенем.