Детерминированность процесса клеточного старения предполагает наличие молекулярного механизма, позволяющего клетке " отсчитывать" число пройденных удвоений. ДНК является единственной макромолекулой, обладающей достаточной стабильностью, чтобы служить базой такого механизма. Основой функционирования "молекулярных часов" могут быть изменения ДНК, сопряженные с процессом ее репликации, такие как метилирование ДНК, либо потеря части ДНК в результате ее неполной репликации. В натоящее время роль "молекулярных часов" отводится теломерам линейных хромосом эукариотических клеток.
Хромосомы позвоночных оканчиваются последовательностью ТТАGGG, повторенной в теломерахсотни и тысячи раз (Blackburn E.H., 1991). Считается, что функциями теломерного повтора является защита хромосом от деградации и предотвращение их слияния друг с другом (Zakian V.A., 1989; Counter C.M. et al., 1992). Анализ длины теломерных повторов выявил, что соматические клетки теряют от 50 до 200 нуклеотидов при каждом клеточном делении (Harley C.B. et al., 1990). Причиной этого явления является неполная репликация концов хромосом из-за особенностей молекулярного механизма репликативного синтеза ДНК (Оловников А.М., 1971;Watson J.D., 1972). Отстающая цепь репликативной вилки в синтезе ДНК не может синтезироваться до 5'-конца в отсутствие рибопраймера, который, в свою очередь, не образуется непосредственно на концевом фрагменте. Потери концевой ДНК делают невозможной бесконечную пролиферацию. Предполагают, что укорачивание хромосом до определенного размера индуцирует процессы клеточного старения, а длина теломер, по этим представлениям, может служить мерой пролиферативного потенциала клеток (Allsopp R.C. et al., 1992).
Предложено несколько гипотетических моделей, объясняющих каким образом клетка "определяет" длину своих теломер и в определенный момент запускает механизм блока пролиферации. Возможно, определяется общее количество ТТАGGG повторов благодаря учету специфически связывающегося с ними белка (Kipling D. et al., 1992).
Другая модель исходит из того, что длинные теломеры молодых клеток находятся в области гетерохроматина. Предполагается, что ген, супрессирующий программу клеточного старения, локализован в субтеломерном районе. По мере укорачивания теломер область гетерохроматина включает в себя все больше субтеломерной ДНК. Включение в эту область гена-супрессора приводит к его инактивации и запуску механизма клеточного старения (Wright W.E., Shay J.W., 1992).
В противоположность соматическим смертным клеткам, то есть клеткам, обладающим пределом размножения in vitro, большинство иммортальных клеток, обладающих способностью к бесконечной пролиферации, содержит теломеразу (Kim N.W. et al., 1994).
Обнаружено, что в соматических клетках, делящихся в организме, длина теломер со временем уменьшается. Укорочение тепомер наблюдается также по мере старения фибробластов в культуре. Более того, оказалось, что длина теломер лучше предсказывает способность клетки к делению, чем возраст донора клеток. Предположительно, теломеры укорачиваются в результате того, что механизм, ответственный за удвоение ДНК в процессе клеточного деления, делает характерную ошибку - в каждой новой копии ДНК элиминируется маленький участок каждой теломеры (Мойзис. Р.,1991) Из этого следует, что теломеры могут быть теми часами, которые определяют в клетках потерю способности к пролиферации. Интересно, что, по данным Харли и Грейдера, длина теломер сохраняется или даже немного увеличивается в сперматозоидах и в трансформированных ("бессмертных") клетках. Такое постоянство помогает объяснить, каким образом половые и злокачественные клетки не утрачивают способности к делению.
Можно, таким образом, выдвинуть предположение, что организм в целом угасает, когда его отдельные органы неизбежно утрачивают способность замещать поврежденные клетки. Однако, как отмечают скептики, люди ведь не умирают от того, что их фибробласты перестают удваиваться. Обычно у клеток остается неиспользованный запас потенциальных делений, когда их "владелец" погибает. В числе критических аргументов также заявляется, что изучение ослабления способности к пролиферации никак не проясняет процессы, приводящие к гибели неделящихся клеток, а именно нейронов и клеток сердечной мышцы, которые годами превосходно функционируют. Мало изучать процесс клеточной пролиферации, его возможности и пределы - надо еще показать, как получаемые результаты соотносятся со старением человека.
Генетические изменения, наблюдаемые в фибробластах, отражают, быть может, лишь один аспект процесса старения, но зато весьма важный.
Возможно, возникают локальные области, в которых клетки функционируют неправильно и не могут быть заменены. Например слой эндотелия кровеносных сосудов толщиной в одну клетку. Если клетки эндотелия на небольшом участке кровеносного сосуда теряют способность к пролиферации и утрачиваются или же не функционируют, это может привести к атеросклерозу. Кроме того, уменьшение способности к пролиферации составляет серьезную проблему в иммунной системе.
Как соотносятся результаты, полученные на фибробластах, с эволюционными гипотезами? Многие исследователи, считают, что ограничение пролиферации могло возникнуть не как "программа смерти", а как защитный механизм против рака. В таком случае потеря способности к клеточному делению является еще одним примером антагонистической плейотропии. Хотя многие люди в конце концов заболевают раком, человеку присуща сопротивляемость, обеспечивающая значительно меньшую подверженность опухолям по сравнению с животными.
Соматические клетки совершают ограниченное число делений в культуре и приходят в состояние необратимой остановки в фазах клеточного цикла G1 и G2/M, которое и называется старением (senescence). Было высказано предположение, что укорочение теломер, связанное с проблемой концевой репликации, служит митотическими часами, работа которых в конце концов приводит к старению. Предложено несколько моделей для объяснения того, как укорочение теломер ведет к старению клетки. Мы ранее предположили, что укорочение теломер может в конце концов привести к формированию дицентрических хромосом, последующий разрыв которых активирует реакцию на повреждение ДНК, опосредованную белком р53. Поэтому мы предположили, что сигнал укорочения теломер воспринимается клеткой как повреждение ДНК.
Получены экспериментальные доказательства посттрансляционной активации белка р53 в фибробластах человека, в которых происходят укорочение теломер и последующее старение в культуре. В этой статье мы также показываем, что повышение активности белка р53 совпадает с формированием дицентрических хромосом и старением. Ранее мы также показали, что повышение уровня p21WAF1/SDll/CIP1, т.е. иерархически одной из ближайших мишеней белка р53, зависит как от белка р53, так и от рЗОО. Мы также показали, что фибробласты, взятые у больных с атаксией-телангиэктазией, ускоренно теряют теломерную ДНК, активируют белок р53 и подвергаются преждевременному старению в культуре. Эти данные свидетельствуют о том, чтоATM и р53 участвуют в мониторинге и регуляции теломерной ДНК. После достижения критической длины теломерной ДНК ATM и р53 воспринимают и передают этот сигнал в клеточный цикл, что ведет к старению.
Ходьба удлиняет жизнь и теломеры Всего лишь изменением образа жизни удалось добиться удлинения теломер. Ника Котова 17.09.2013, 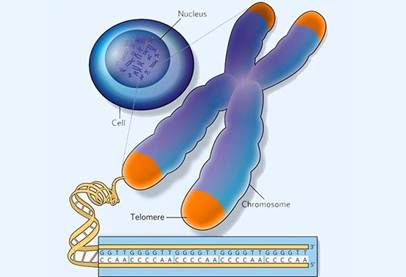
Теломеры - счетчик жизни
У пациентов с раком простаты, перешедших на здоровый образ жизни, за пять лет теломеры удлинились на 10%. Ученые обнадежены результатом.
В наших клетках работает счетчик, отсчитывающий время их жизни, это теломеры – защитные «колпачки» на концах хромосом, которые укорачиваются при каждом делении клетки. Теломеры состоят из последовательности нуклеотидов, которая «недочитывается» при каждом последующем делении и поэтому становится все короче. Теломеры могут надстраиваться – это умеет делать фермент теломераза, но она активна только в стволовых и в раковых клетках. За открытие работы теломеразы Элизабет Блэкбёрн, Кэрол Грейдер и Джек Шостак в 2009 году получили Нобелевскую премию по физиологии и медицине.
Теломеры считают показателем старения, «термометром для измерения возраста».
Существует множество исследований, в которых длину теломер связывают с биологическим возрастом и предрасположенностью к разнообразным заболеваниям включая рак, инсульт, деменцию, сердечно-сосудистые заболевания, диабет.
Разработан даже тест для оценки потенциала здоровья по длине теломер.
В общем, чем длиннее теломеры в клетках, тем больше у человека потенциал долголетия и здоровья. Но удлинять теломеры, активизируя фермент теломеразу, задача небезопасная, так как она связана с риском перерождения клетки в раковую.
Поэтому результаты, полученные учеными Калифорнийского университета в Сан-Франциско и опубликованные в журнале The Lancet Oncology, выглядят удивительно. Исследователи показали, что теломеры могут удлиниться очень простым способом, без всяких биохимических воздействий – всего лишь изменением образа жизни.
Рецепт удлинения: правильная диета, физическая активность, контроль стресса и социальная поддержка.
«Люди часто думают: у меня плохие гены, и я ничего не могу с этим поделать, это моя судьба, — говорит Дин Орниш, профессор клинической медицины, руководитель исследования. – Но наша работа показала, что теломеры могут удлиняться, когда люди просто меняют свой образ жизни. А длинные теломеры означают меньше болезней и долгую жизнь».
В течение пяти лет специалисты наблюдали за 35 мужчинами с локализованной раковой опухолью простаты, находившейся на ранней стадии. В ходе исследования у них измеряли длину теломер и оценивали активность теломеразы.
10 пациентов из 35 изменили образ жизни. Они включили в свой рацион много овощей и фруктов, зерновые продукты, уменьшили количество жиров и сахара. Занялись физическими упражнениями или просто ходили не менее 30 минут в день. Приняли меры к тому, чтобы научиться контролировать стресс, чему помогала йога, медитация. Пациенты также посещали сеансы групповой терапии, где получали социальную поддержку.
Другие 25 человек не внесли никаких изменений в свой образ жизни.
Результаты удивили даже исследователей – в группе пациентов, перешедших на здоровый образ жизни, за пять лет теломеры удлинились в среднем на 10%. Причем, чем больше изменений произошло в образе жизни, тем длиннее стали теломеры.
В то же время в контрольной группе пациентов теломеры за пять лет жизни, наоборот, укоротились примерно на 3%.
Ученые считают, что этот феномен не ограничивается только пациентами с раком простаты, но должен распространяться и на всех остальных людей.
В предыдущем исследовании, которое было проведено в 2008 году, участники меняли образ жизни всего лишь на три месяца, и за это время ученые обнаружили в их клетках повышение активности теломеразы. Теперь же этот эффект удалось повторить на большем отрезке времени.
«Поскольку укорачивание теломер увеличивает риск развития множества хронических болезней, — говорит участник исследования Питер Кэррол, — мы полагаем, что удлинение теломер может предохранять от этих болезней и, возможно, увеличивать продолжительность жизни».
Ученые из Стэнфордского университета разработали метод стимуляции концевых участков хромосом, которые отвечают за старение человека.
Теломеры — это концевые участки хромосом, которые выполняют защитную функцию. Существует так называемый предел Хейфлика, связанный с сокращением длины теломер — количество делений соматических клеток приблизительно равно 50, после чего клетки начинают проявлять признаки старения. Как показали исследования, восстанавливать ДНК способен фермент теломераза, который воздействует на теломеры, восстанавливая их изначальную длину.
Новая технология использует модифицированную РНК, несущую в себе ген обратной теломеразной транскриптазы (TERT). Введение рибонуклеиновой кислоты многократно повышает активность теломеразы на 1−2 дня, за которые та активно удлиняет теломеры, и запрограммированная РНК распадается. Полученные в итоге клетки ведут себя аналогично «молодым» и делятся во много раз интенсивнее, чем клетки контрольной группы.
Таким образом удалось удлинить теломеры более чем на 1000 нуклеотидов, что эквивалентно нескольким годам человеческой жизни. Что важно, процесс совершенно безопасен для здоровья и не приводит к неконтролируемому делению клеток: иммунная система просто не успевает отреагировать на введенную в организм РНК, которая бесследно распадается. Открытие поможет увеличить количество клеток для исследований медицинских препаратов и моделирования заболеваний, а в перспективе и для продления жизни.