· Закон Бойля — Мариотта
pV=constпри T= const, m=const,
где р — давление; V — объем; T — термодинамическая температура; m— масса газа.
· Закон Гей-Люссака
V= Vо (1 + αt), или V1/V2 = T1/T2 при р=const, m=const;
p=p0(1+αt), или p1/p2 =Tl/T2 при V= const, m=const,
где t — температура по шкале Цельсия; Vо и p0 — соответственно объем и давление при 0°С; коэффициент α=1/273 К-1; индексы 1 и 2 относятся к произвольным состояниям.
· Закон Дальтона для давления смеси п идеальных газов
 ,
,
где рi — парциальное давление i-го компонента смеси.
· Уравнение состояния идеального газа (уравнение Клапейрона — Менделеева)
pVm=RT (для 1 моль газа),
pV=(m/M)RT (для произвольное массы газа),
где Vm — молярный объем;
R — молярная газовая постоянная;
М — молярная масса газа;
т — масса газа;
т/М= v — количество вещества.
· Зависимость давления газа от концентрации n молекул и температуры Т
p=пkТ,
где k — постоянная Больцмана (k=R/NA, NA — постоянная Авогадро).
· Основное уравнение молекулярно-кинетической теории идеальных газов 
или 
или 
где <vкв> — средняя квадратичная скорость молекул; Е — суммарная кинетическая энергия поступательного движения всех молекул газа; n — концентрация молекул; m0— масса одной молекулы; m =N m0— масса газа; N — число молекул в объеме газа V.
· Скорость молекул:
наиболее вероятная 
средняя квадратичная 
средняя арифметическая 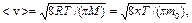
где m0 — масса молекулы.
· Средняя кинетическая энергия поступательного движения молекулы идеального газа
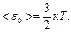
 ПриложениеБ
ПриложениеБ
Примеры решения задач
Задача 1
Дано: Решение
1.Т1= 1).Параметры, описывающие I состояние газа:P1; V1; T1
Р1= для данного состояния, уравнение М-К: P1V1=ν1RT1=>
V1= T1=P1V1/ν1R (1)
2.T1=const(V↓) 2).Газ сжали изотермически. Параметры, описывающие II
P2= состояние газа: P2; V2; T1
V2= 3).Состояние газа изменяется по изотермическому процессу
3.P2=const(T↑) (T1=const) для двух состояний газа закон Б-М:
T3= P1/P2=V1/V2=>V2=P1*V1/P2 (2)
R=8,31Дж/моль*К
Найти:V2-? 4).

5).Газ нагрели изобарически. Параметры, описывающие III состояние газа:P2; T3; V3
Уравнение III состояния газа (уравнение М-К) P2V3=ν2RT3=>V3= ν2RT3/ P2 (3)
Задача 2
В комнате объемом 40 м3 температура воздуха 200С, его относительная влажность  . Сколько надо испарить воды, чтобы относительная влажность
. Сколько надо испарить воды, чтобы относительная влажность  достигла 50%? Известно, что при 200С давление насыщающихся паров
достигла 50%? Известно, что при 200С давление насыщающихся паров  .
.
Дано: 
Решение. Относительная влажность равна
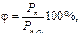
отсюда

Давления пара при относительных влажностях  и
и  равны
равны

Плотность связана с давлением равенством  откуда
откуда

Массы воздуха в комнате при влажностях  и
и  равны
равны
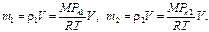
Масса воды, которую надо испарить, равна

Задача 3
 В сосуде находится
В сосуде находится  азота и
азота и  водорода при температуре
водорода при температуре  и давлении
и давлении  . Найти: 1) молярную массу смеси; 2) объем сосуда.
. Найти: 1) молярную массу смеси; 2) объем сосуда.
Решение. Молярная масса смеси  есть отношение массы смеси
есть отношение массы смеси  к количеству вещества смеси
к количеству вещества смеси  , т.е.
, т.е.  (1). Масса смеси равна сумме масс компонентов смеси
(1). Масса смеси равна сумме масс компонентов смеси  . Количество вещества смеси равно сумме количеств вещества компонентов
. Количество вещества смеси равно сумме количеств вещества компонентов
 (2)
(2)
Подставим в формулу (1) выражения  и
и  получим
получим
 (3)
(3)
Запишем уравнение Менделеева-Клапейрона 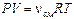 . Подставив в это уравнение выражение (2), получим искомый объем
. Подставив в это уравнение выражение (2), получим искомый объем
 (4)
(4)
Подставив значения величин  и
и  , а также
, а также  - молярная масса азота и
- молярная масса азота и  - молярная масса водорода в выражение (3), получим
- молярная масса водорода в выражение (3), получим

Подставив значения величин  , а также
, а также  в (4), получим:
в (4), получим:

Приложение В