Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов. Вода диссоциирует на ионы:
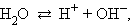
ее константа при 298 K равна

При столь малой константе диссоциации концентрация воды остается практически неизменной и равной

Отсюда произведение постоянных величин K д∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды K в, равна

Таким образом, в пределах 15–25 °C ионное произведение воды K в = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде [H+] = [OH–] = 1 ∙ 10–7, при [H+] > 1 ∙ 10–7 – кислой, при [H+] < 1 ∙ 10–7 – щелочной.
По концентрации ионов водорода можно судить о характере среды раствора:
[ H ] = [ OH ] = 10 - нейтральная среда
[ H ]> 10 > [ OH ] - кислая среда
[ H ]< 10 < [ OH ] - щелочная среда
Следует отметить, что характеризовать кислотность или щелочность раствора числами с отрицательными показателями степени очень неудобно. Поэтому степень кислотности или щелочности растворов принято выражать не концентрацией ионов Н+, а ее десятичным логарифмом, взятым с обратным знаком. Эту величину называют водородным показателем и обозначают через рН:
рН = - lg [H+]
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Пример 1. Определить pH раствора, в литре которого содержится 0,0085 г гидроксильных ионов.
Решение.

Из ионного произведения воды [H+][OH–]=1∙10–14
[H+] = 1 · 10 -14 / 5 · 10 -3 = 2∙10–10;
pH= –lg [H+] = – lg 2∙10–10 = 9,7.
Задания для самостоятельной работы.
Вариант №1
Задание 1. Найти массовую долю азотной кислоты в растворе, в 1 л которого содержится 224 г HNO3 (ρ= 1,12 г/ мл).
Задание 2. Раствор, в 100 мл, которого находится 2, 30 г вещества, обладает при 298 К осмотическим давлением 618,5 кПа. Определите молекулярную массу вещества.
Задание 3. [ Н+ ] = 1 ·10-3 моль/л. рН-?
Вариант №2
Задание 1. При 25 оС растворимость NaCI равна 36,0 г в 100 г воды. Найти массовую долю NаCI в насыщенном растворе.
Задание 2. Рассчитайте молярную массу неэлектролита, если в 5 л раствора содержится 1,7 гнеэлектролита. Осмотическое давление этого раствора 0,25∙105 Па при 20 оС.
Задание 3. рН = 7. [ Н+ ] -? [ ОН- ] -?
Вариант №3
Задание 1. Из 400 г 50%-ного раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе?
Задание 2. Температура кипения водного раствора сахарозы С12Н22О11 равна 101,4 оС. Вычислите массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор?
Задание 3. [ ОН- ] = 1 ·10-5 моль/л. рН -?
Вариант №4
Задание 1. Найти массовую долю глюкозы в растворе, содержащем 280 г воды и 40 г глюкозы.
Задание 2. При какой приблизительно температуре будет кипеть 50%-ный раствор сахарозы С12Н22О11?
Задание 3.[ Н+ ] = 1 ·10-10 моль/л. рН -?
Вариант №5
Задание 1. При охлаждении 300 г 15%-ного раствора часть растворенного вещества выпала в осадок, и концентрация раствора стала 8%. Чему равна масса выпавшего в осадок вещества?
Задание 2. При какой температуре будет кристаллизироваться 40%-ный раствор этилового спирта С2Н5ОН?
Задание 3. рОН = 12. рН -? [ Н+ ] -?
Вариант №6
Задание 1. Найти молярность и нормальность 15%-ного раствора H2SO4 (ρ= 1,10 г/мл).
Задание 2. При какой температуре будет кристаллизироваться 60%-ный раствор этанола С2Н5ОН?
Задание3.[ ОН- ] = 1 ·10-4 моль/ л. рН -?
Вариант №7
Задание 1. Какой объём 96%-ной серной кислоты (ρ=1,84 г/мл) и какую массу воды нужно взять для приготовления 100 мл 15%-ного раствора (ρ=1,10 г/мл).
Задание 2. Определите, сколько этилового спирта С2Н5ОН надо прибавить к 0,7 л воды, чтобы температура замерзания полученного раствора составила -8 оС?
Задание 3. рН = 6. [ Н+ ] -? [ ОН- ] -?
Вопросы для самопроверки
1. Перечислите известные вам способы выражения концентрации.
2. Если известна массовая доля растворенного вещества, какова будет его моляльность?
3. Если известна массовая доля растворенного вещества и плотность этого раствора, определите его молярную концентрацию.
4. Каков объем H2SO4 c C = 2 моль·л–1 следует взять для приготовления 1,5 л раствора с C Э = 0,025 моль·л–1.
5. Перечислите концентрации, не меняющие свою величину при изменении температуры.
6. При взаимодействии 10 мл NaCl с 5 мл раствора AgNO3 с C = 0,1 моль·л–1 в осадок выпал весь AgNO3. Найти молярную концентрацию NaCl.
7. Какие растворы называют идеальными?
8. Сформулируйте законы идеальных растворов (Рауля и Вант-Гоффа).
9. В чем состоит явление осмоса? Приведите примеры, где осмос и осмотическое давление проявляется наиболее ярко.
10. В чем преимущество осмометрического метода определения молекулярных масс растворенных соединений.
11. Какое из веществ: неэлектролит глюкоза (C6H12O6) и два электролита NaCl и BaCl2 при эквимолекулярной концентрации способно к наибольшему понижению температуры замерзания водного раствора?
12. Дайте определение электролитам и неэлектролитам.
13. Чем активность отличается от концентрации. От каких факторов зависит коэффициент активности электролитов?
14. Что такое ионная сила раствора электролита?
15. Какие из перечисленных соединений способны гидролизоваться в водном растворе: NaOH, HCl, NaCl, NaHCO3, (CH3COO)2Ca, CH3COONH4? Напишите реакции гидролиза в молекулярной и сокращенной ионной формах.