АЛКАНЫ(ПАРАФИНЫ)
– это предельные (или насыщенные) нециклические углеводороды, в которых все связи одинарные.
| Общая формула: CnH2n+2 | Все атомы углерода в алканах имеют sp3- гибридизацию. | Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества. Все алканы легче воды, не растворимы в воде и не смешиваются с ней. |
Химические свойства.
1) Связь углерода с водородом в алканах малополярна.
2) Поэтому разрыв её в реакциях возможен только по гомолитическому механизму:

Это возможно только в жестких условиях.
3) Насыщенные (предельные) углеводороды не имеют возможности вступать в реакции присоединения. Для них свойственны реакции замещения водородных атомов и расщепления. Эти реакции протекают или при нагревании, или на свету, или с применением катализаторов.
Алканы не реагируют с концентрированными кислотами, щелочами, перманганатом калия, бромной водой.
I. Реакции замещения.
| 1) Галогенирование: радикальное замещение. Хлор и бром на свету или при нагревании. | А) хлорирование: процесс быстрый, поэтому протекает неизбирательно, образуется смесь продуктов замещения:
СН3-СН2-СН3 + Cl2–(свет)à CH3-CH2-CH2Cl + CH3-CHCl-CH3 + HCl
Б) бромирование:
CH3 CH3
│ │
СН3-СН2-СН-СН3 +Br2 –(свет)àСН3-СН2-С-СН3 + HBr
│
Br
Бромирование – более медленный и избирательный процесс.
Избирательность бромирования:
третичный > вторичный > первичный атом углерода.
Механизм радикального замещения: Цепной свободнорадикальный.
Свободный радикал R∙– это ОЧЕНЬ АКТИВНАЯ частица, несущая на себе один неспаренный электрон и стремящаяся образовать связь с каким-либо другим атомом.
1) Инициирование цепи (запуск): молекула хлора под действием кванта света разрывается на два радикала Cl·:
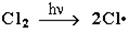 2) Развитие цепи: радикал хлора отрывает от алкана атом водорода. При этом образуется промежуточная частица - алкильный радикал, который в свою очередь отрывает атом хлора от молекулы Cl2. При этом вновь получается радикал хлора и процесс повторяется – идёт продолжение цепи:
2) Развитие цепи: радикал хлора отрывает от алкана атом водорода. При этом образуется промежуточная частица - алкильный радикал, который в свою очередь отрывает атом хлора от молекулы Cl2. При этом вновь получается радикал хлора и процесс повторяется – идёт продолжение цепи:
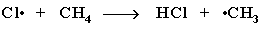
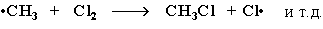 3) Обрыв цепи: соединение двух радикалов в молекулу.
3) Обрыв цепи: соединение двух радикалов в молекулу.
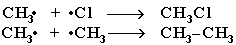
|
| 2) Нитрование (реакция М.И. Коновалова): | Механизм реакции – также радикальный. Нагревание до 140°С с разбавленной (10%-ной) азотной кислотой: CH3 CH3 │ │ СН3-СН2-СН-СН3 + HNO3 à СН3-СН2-С-СН3 + H2O │ Избирательность нитрования: NO2 третичный > вторичный > первичный атом углерода. |
| 3) Крекинг - превращения алканов под действием нагревания. | а) Для алканов с длинными цепями при крекинге получается алкан и алкен. Причём при длине больше 5 атомов С получится смесь углеводородов разной длины. CH3–CH2–CH2–CH3 -400°Cà CH3-CH3 + CH2=CH2 б) Крекинг метана происходит двумя возможными путями: 1. длительное нагревание метана: CH4 -1500°Cà C+ 2H2 2. мгновенное нагревание до 1500 градусов и сразу охлаждение: 2CH4 -1500°CàH–C≡C–H + 3H2 ацетилен |
| 4) Изомеризация – перестройка углеродного скелета с образованием других изомеров:при нагревании с катализатором AlCl3. | СН3-СН2-СН2-СН3 -(100о, AlCl3)à CH3-CH-CH3 │ CH3 |
| 5) Окисление: | 1) Горение: CH4 + 2O2 ⇆ CO2 + 2H2O C5H12 + 8O2 ⇆ 5CO2 + 6H2O 2) Каталитическое окисление: Метана: СН4+О2 -(катализатор)à смесь СН3ОН, НСОН и НСООН Бутана: С4Н10 + О2 -(катализатор)à2 СН3СООН (уксусная кислота) |
| 6) Дегидрирование и циклизация. | 1) Короткие алканы дегидрируются в алкены или диены:
С2Н6 –(кат., t)àC2H4 + H2
CH3-CH2-CH2-CH3 –(кат.Cr2O3, t)àбутадиен + Н2
2) В присутствии катализатора гексан и гептан превращаются в бензол и толуол соответственно.
СН3-СН2-СН2-СН2-СН2-СН3 –(кат.Pt, t)à 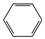 + 4 Н2 + 4 Н2
|
Получение:
|
|
|
|
| 1) Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов: 2CH3–CH2Br + 2Naà CH3–CH2–CH2–CH3 +2NaBr Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов. |
| 2) Декарбоксилирование солей карбоновых кислот(реакция Дюма): сплавление солей карбоновых кислот со щелочами. Так получают метан при нагревании ацетата натрия с гидроксидом натрия. CH3COONa + NaOH(сплавление)àCH4+ Na2CO3 |
| 1) 3) Электролиз растворов солей карбоновых кислот(реакция Кольбе): 2CH3COONa + 2H2O –(эл.ток)à 2СО2 + Н2 + С2Н6 + 2NaOH катод: идёт разрядка воды: 2Н2О + 2е à Н2 + 2ОН- анод: 2) разрядка аниона кислоты: 2СН3СОО- -2е à 2СО2 + СН3-СН3 |
| 4) Гидролиз карбида алюминия – получение метана. Al4C3 + 12H2Oà3CH4 + 4Al(OH)3 |
5) Гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля).
R–CH=CH–R’ + H2 –katà R–CH2–CH2–R’
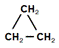 (циклопропан) + H2 –Pdà CH3 –CH2 –CH3(пропан) (циклопропан) + H2 –Pdà CH3 –CH2 –CH3(пропан)
|
| 6) Алканы можно получить из нефти крекингом или фракционной перегонкой. |
Циклоалканы - предельные циклические углеводороды.
Общая формула гомологического ряда CnH2n.

| 
| 
| 
|
| Циклопропан | Циклобутан | Циклопентан | Циклогексан |
| Малые циклы | Большие циклы |
Строение циклоалканов.
Каждый атом углерода в циклоалканах находится в состоянии sp3-гибридизации и образует четыре σ-связи С-С и С-Н.
|
|
Углы между связями зависят от размера цикла. В малых циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность.
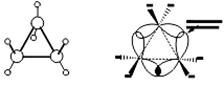 σ-связи в циклопропане называют "банановыми". По свойствам они напоминают ПИ-связи. Поэтому молекулу циклопропана очень легко разорвать и поэтому он способен вступать в реакции присоединения (с разрывом цикла).
σ-связи в циклопропане называют "банановыми". По свойствам они напоминают ПИ-связи. Поэтому молекулу циклопропана очень легко разорвать и поэтому он способен вступать в реакции присоединения (с разрывом цикла).
Циклобутан в пространстве имеет перегиб по линии, соединяющей 1 и 3 атом С в кольце:
Циклопентан имеет форму, которую называют «конверт»:
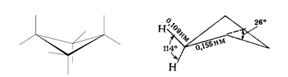
Большие циклы очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
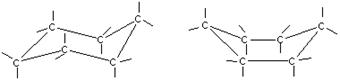
А — кресло б — ванна.
И в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.
Изомерия: 1. Структурная изомерия, связанная:
a) с числом углеродных атомов в кольце:
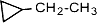 (этилциклопропан),
(этилциклопропан),  (метилциклобутан);
(метилциклобутан);
b) с числом углеродных атомов в заместителях:
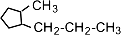 (1-метил-2-пропилциклопентан),
(1-метил-2-пропилциклопентан), 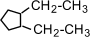 (1,2-диэтилциклопентан)
(1,2-диэтилциклопентан)
c) с положением заместителя в кольце:
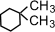 (1,1-диметилциклогексан),
(1,1-диметилциклогексан), 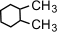 (1,2-диметилциклогексан)
(1,2-диметилциклогексан)
2. Межклассовая изомерия: циклоалканы изомерны алкенам.
3. Геометрическая цис-транс-изомерия:
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
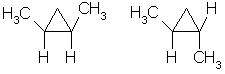
цис-изомер транс-изомер
Получение.
1. Отщепление двух атомов галогена от дигалогеналканов:
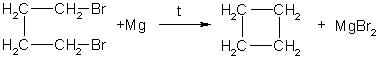
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные: C6H6 + 3H2 -t°,р,Ni→ C6H12.
Химические свойства.
Малые циклы (циклопропан и циклобутан) из-за большой напряженности кольца (малые углы) легко разрываются, вступая в реакции присоединения.
1) Гидрирование. При каталитическом гидрировании трех-, четырех- и даже пятичленные циклы разрываются с образованием алканов.
 (циклопропан) + H2 -120ºC,Nià CH3–CH2–CH3
(циклопропан) + H2 -120ºC,Nià CH3–CH2–CH3
 (циклопентан)+ H2-300ºC,PdàCH3–CH2–CH2–CH2–CH3
(циклопентан)+ H2-300ºC,PdàCH3–CH2–CH2–CH2–CH3
Пятичленный цикл разрывается только при высоких температурах.
2) Галогенирование. Циклопропан и циклобутан разрываются, присоединяя атомы галогена.
 + Br2 à BrCH2–CH2–CH2Br (1,3- дибромпропан)
+ Br2 à BrCH2–CH2–CH2Br (1,3- дибромпропан)
3)Гидрогалогенирование. Циклопропан и замещенные циклопропаны взаимодействуют с галогеноводородами с разрывом цикла.

В случае замещенных циклопропанов реакция идёт в соответствии с правилом Марковникова.
Другие циклоалканы с галогеноводородами не реагируют.
Большие циклы – циклопентан и циклогексан – гораздо более устойчивы, цикл в них не разрывается. Они ведут себя подобно алканам, вступая в реакции замещения: галогенирование на свету, нитрование.
1) Галогенирование: циклопентан и циклопентан реагируют с галогенами на свету, вступая в реакцию замещения.
 + Cl2-(свет)à
+ Cl2-(свет)à  (хлорциклопентан) + HCl
(хлорциклопентан) + HCl
Нитрование.
Циклопентан + HNO3 –(t,p)à нитроциклопентан + вода.
3. Дегидрирование. Производные циклогексана дегидрируются в производные бензола:

| ––300°C,Pdà | 
| + 3H2 |
4. Горение. Как и любые органические вещества, циклоалканы горят с образованием углекислого газа и воды.