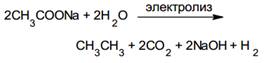Мотивация к изучению материала
При изучении химии элемента углерода вы узнали, что такие соединения, как оксид углерода (IV), оксид углерода (II), угольная кислота, карбонаты и ряд других относятся к неорганическим веществам. А вот углеводороды и их производные (спирты, карбоновые кислоты, альдегиды и др.) относят к органическим веществам. Помимо углерода и водорода, в состав молекул органических веществ могут входить кислород, азот, фосфор, сера и галогены.
Актуализация опорных знаний
1) Что изучает органическая химия?
2) Какие вещества называют изомерами?
3) Какие вещества называют гомологами?
4) Назовите известные вам теории, возникшие в органической химии в начале XIX века.
Изучение нового материала
Теория химического строения органических соединений раскрывает закономерности и порядок связи атомов друг с другом в молекулах. Разработана А.М. Бутлеровым в 1861г.
Основные положения теории.
1. Атомы в молекулах органических веществ соединены между собой химическими связями в определенной последовательности согласно их валентности. Углерод в органических соединениях всегда четырехвалентен.
Формулы строения:
а) структурная формула - описывает порядок соединения атомов в молекуле, т.е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывается (такие формулы называются сокращенными структурными).
Например, полная и сокращенная структурные формулы н-бутана C4H10 имеют вид:
Н Н Н Н
׀ ׀ ׀ ׀
Н – С – С – С – С – Н СН3 – СН2 – СН2 – СН3
׀ ׀ ׀ ׀
Н Н Н Н
полная структурная формула сокращенная структурная формула
б) молекулярная (брутто) формула C4H10, показывает только, какие элементы и в каком соотношении входят в состав вещества (т.е. качественный и количественный элементный состав), но не отражает порядка связывания атомов.
2. Свойства органических веществ зависят не только от их качественного и количественного состава, но и от порядка их расположения атомов в молекуле, т.е. от химического строения молекулы.
Например, н-бутан и изобутан имеют одну молекулярную формулу C4H10, но разную последовательность связей
Н Н Н Н Н Н Н
׀ ׀ ׀ ׀ ׀ ׀ ׀
Н – С – С – С – С – Н Н – С – С – С – Н
׀ ׀ ׀ ׀ ׀
Н Н Н Н Н - С -Н
׀
н- бутан Н изо- бутан
2.1. Способность атомов углерода соединяться в различном порядке друг с другом и с атомами других элементов, обусловливает явление изомерии.
2.2. Вещества, имеющие одинаковый количественный и качественный состав молекул, но различное химическое строение и свойства называются изомерами.
2.3. Существует два основных типа изомерии – структурная и пространственная.
2.4. Структурная изомерия определяется различным порядком соединения атомов в молекуле. Различают три вида структурной изомерии:
· вид изомерии, связанный с изменение строения углеродной цепи, называется изомерией углеродного скелета (изомерией цепи). Например, пентан имеет следующие изомеры
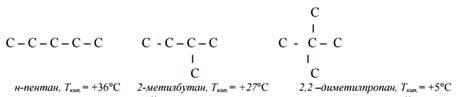
· вид изомерии, связанный с изменением места расположения кратной связи и /или атомов и групп атомов (галогенов, гидроксо-, нитрогрупп и др.), заместивших атомы водорода в углеродной цепи, называется изомерией положения. Например,
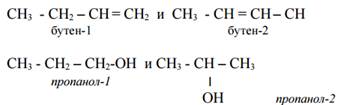
· межклассовая изомерия. Изомеры имеют одинаковую молекулярную формулу, но относятся к разным классам органических соединений. Например, этиловый спирт и диметиловый эфир отвечают формуле С2Н6О: СН3 - СН2 – ОН спирт Tкип.= +78,4°С; СН3 - О - СН3 эфир Tкип.= -23,7°С
2.5. Пространственная изомерия обусловливается различным расположением атомов и групп атомов в пространстве.
Пространственная изомерия подразделяется на: а) геометрическую (цис- и транс- изомерию), она возможна при наличии двойной связи в корне молекулы:

б) Оптическая (зеркальная), она возможна при наличии ассиметричного атома углерода (при атоме углерода 4 разных заместителя).
3. Молекула каждого вещества обладает определенным химическим строением, которое может быть установлено химическими методами. Изучая свойства вещества можно определить химическое строение его молекулы, а по строению молекулы - предвидеть свойства вещества.
4. Атомы или группы атомов, образующие молекулу, взаимно влияют друг на друга, от чего зависят и химические свойства соединения.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
АЛКАНЫ
Алканы – это предельные углеводороды нециклического строения. Их называют также парафинами.
Общая формула алканов – CnH2n+2.
В гомологическом ряду алканов температуры плавления и кипения увеличиваются с ростом молекулярной массы веществ. Метан, этан, пропан и бутан – газы без цвета и запаха. Алканы с числом атомов углерода от 5 до 15 при обычных условиях бесцветные жидкости, начиная с углеводорода С16Н34 – твердые, белые, воскоподобные вещества.
Алканы практически нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях, например, в бензоле. Плотность жидких алканов немного меньше, чем у воды.
СТРОЕНИЕ МОЛЕКУЛ АЛКАНОВ
Каждый атом углерода в молекулах алканов образует четыре простые σ-связи с атомами водорода или другими атомами углерода. Электронныеорбитали атомов углерода находятся в состоянии sp3-гибридизации. Гибридные орбитали, а, значит, и связи каждого атома углерода направлены к вершинам тетраэдра.
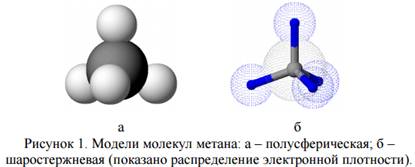
Валентный угол в молекуле метана и его гомологов составляет 109,5◦. Поэтому углеродная цепь в молекулах алканов имеет зигзагообразную форму:
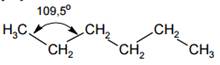
Вокруг σ-связей С-С возможно вращение, в результате которого молекулы могут принимать различные формы, называемые конформациями.
Углеродный скелет молекул алканов может иметь как нормальное, так и разветвленное строение. В молекулах гомологов метана различают первичные, вторичные, третичные и четвертичные атомы углерода.
Связи С-С в молекулах алканов являются ковалентными неполярными, а связи С-Н – ковалентными полярными. Однако значения электроотрицательности атомов углерода и водорода близки и равны соответственно 2,5 и 2,1 по Полингу. Поэтому по свойствам связь С-Н близка к неполярной и проявляет склонность к гомолитическому разрыву с образованием свободных радикалов:
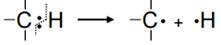
Следовательно, для алканов характерны реакции, протекающие по радикальному механизму.
НОМЕНКЛАТУРА АЛКАНОВ
В соответствии с рекомендациями ИЮПАК при построении названий алканов соблюдают следующие правила.
1. Находят основную, то есть самую длинную углеродную цепь. Название основной цепи совпадает с названием алкана с тем же числом углеродных атомов. Суффикс –ан указывает на принадлежность углеводорода к классу алканов.
2. Нумеруют атомы углерода в основной цепи, начиная с того конца, к которому ближе располагается первый из имеющихся заместителей.
3. Формулируют название алкана. Для этого перечисляют заместители в алфавитном порядке, (например, сначала метил-, затем этил-), указывая перед каждым заместителем номер атома углерода основной цепи, к которому он прикреплен, и добавляют название основной цепи.
Если одинаковых заместителей два, три или четыре, то используют умножающие приставки ди-, три- и тетра- соответственно.
Пример. Назовем алкан, структурная формула которого изображена ниже.

Самая длинная углеродная цепь в формуле алкана выделена жирным шрифтом. Она содержит 8 атомов углерода. Алкан с таким же числом атомов углерода называется октан. Это слово и будет основой названия всего вещества.
В молекуле три заместителя – два радикала СН3- и один СН3-СН2-. Нумерацию атомов углерода ведем в данном случае справа налево, тогда атом углерода, к которому прикреплен ближайший к началу цепи заместитель СН3- получит номер 2.
Перечисляем заместители по алфавиту, указывая перед каждым из них цифрой номер атома углерода основной цепи, к которому он прикреплен, и добавляем название основной цепи - слово октан.
Итак, название алкана 2,6-диметил-3-этилоктан.
ВИДЫИЗОМЕРИИ
Для алканов характерен только один вид структурной изомерии - изомерия углеродного скелета.
Ниже приведены структурные формулы всех изомеров гексана С6Н14.
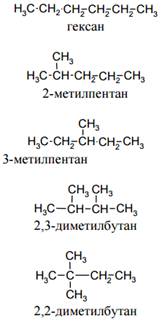
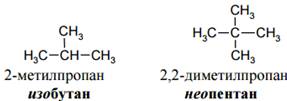
Для некоторых разветвленных алканов наряду с систематическими названиями используют и тривиальные:
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Предельные углеводороды при обычных условиях химически инертны, поскольку для начала реакции с их участием нужно разорвать весьма прочные связи С-С или С-Н. Поэтому алканы не реагируют при обычных условиях с такими активными веществами, как серная и азотная кислоты, металлический натрий, перманганат калия.
Реакции присоединения для алканов невозможны, так как все их валентности насыщены. Алканы могут вступать в реакции горения и каталитического окисления.
Реакции радикального замещения атомов водорода
· Галогенирование
Хлорирование алканов протекает под действием солнечного света, УФ-излучения или сильного нагревания (до 300-500оС):
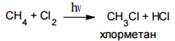
При избытке хлора может происходить дальнейшее замещение атомов водорода:
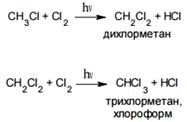
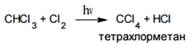
Эта реакция протекает по радикально- цепному механизму.
Реакция бромирования протекает аналогично, но с меньшей скоростью:
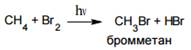
Реакции с фтором и иодом на практике не проводят: фтор действует слишком энергично, разрушая молекулу, иодирование протекает слишком медленно и с очень низкими выходами.
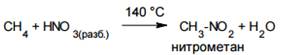
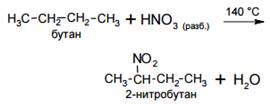
· Нитрование
Нитрование алканов (реакция Коновалова) происходит при их нагревании с разбавленной азотной кислотой, например:
Термические превращения алканов
При нагревании алканов до высоких температур без доступа воздуха в присутствии катализаторов протекают реакции, сопровождающиеся разрывом связи С-С (крекинг, изомеризация). В промышленности эти процессы используют при переработке нефти. Возможны реакции дегидрирования и дегидроциклизации, приводящие к получению алкенов, алкадиенов и ароматических углеводородов.
· Крекинг
Разрыв связей между атомами углерода в молекулах алканов происходит при температурах выше 400оС. Этот процесс носит название крекинг.
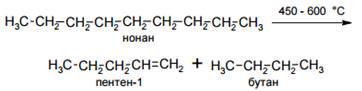
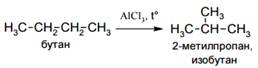
· Изомеризация
· Дегидрирование
Дегидрирование алканов – обратимый каталитический процесс. В качестве катализаторов используют металлы платиновой группы (Pt, Pd, Ni) или Cr2O3, нанесенный на пористый инертный носитель. Температура варьируется от 300 до 600оС.

Горение и каталитическое окисление
Алканы горят на воздухе сообразованием углекислого газа и воды:
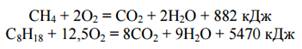
СПОСОБЫПОЛУЧЕНИЯ АЛКАНОВ
· Промышленные способы
Основной промышленный способ получения алканов – переработка нефти.
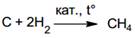
· Лабораторные способы
1. Гидролиз карбида алюминия позволяет получить метан:
Al4C3 + 12H2O→ 4Al(OH)3 + 3CH4
2. Сплавление натриевых солей карбоновых кислот со щелочами.
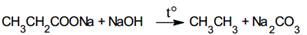
3. Реакция галогеналканов с натрием (реакция Вюрца)

4. Электролиз водных растворов натриевых или калиевых солей карбоновых кислот (синтез Кольбе)