Фосфор и его соединения (продолжение).
- Получение фосфора:
-в электропечах, сплавляя без доступа воздуха
1. фосфат кальция 2. песок 3.уголь:
Сa3(PO4)2 + 3SiO2 + 5C  2P + 5CO + 3CaSiO3.
2P + 5CO + 3CaSiO3.
- Оксид фосфора Р2О5 – типичный кислотный оксид
(фосфор – неметалл, а оксиды неметаллов – кислотные)
Гидроксид этого оксида – фосфорная кислота:
P2O5 + 3H2O = 2H3PO4 - твёрдое кристаллическое вещество, неограниченно растворяется в воде. Обладает всеми свойствами типичной кислоты:
1. -лакмус краснеет
2. -с раствором кислоты взаимодействуют Ме, стоящие в ЭХРНМ до Н2, получается соль и водород в чистом виде
3. -взаимодействие с щёлочами – реакция нейтрализации
4. -взаимодействие с основными оксидами (оксидами металлов)
Написать уравнения вышеназванных реакций.
Фосфорную кислоту получают:
в промышленности: Ca3(PO4)2 + 3H2SO4 = 2 H3PO4 + 3CaSO4
в лаборатории: 3Р (кр.) + 5HNO3 (разб.) + 2Н2О = 3 H3PO4 + 5NO 
Качественной реакцией на фосфат-ион является реакция с катионом серебра; образуется осадок желтого цвета:
3AgNO3 + K3PO4 = Ag3PO4  + 3KNO3
+ 3KNO3
3Ag+ + 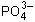 = Ag3PO4
= Ag3PO4 
-Соли ортофосфорной (фосфорной) кислоты: Фосфорная кислота H3PO4 трёхосновная, то есть в молекуле три катиона водорода.
Поэтому при взаимодействии с щелочью может затратиться:
-или три моль щёлочи, не останется водорода и получится соль фосфат
-или два моля щёлочи, останется один водород и получится гидрофосфат
-или один моль щёлочи,останется два водорода и получится дигидрофосфат.

Пример получения дигидрофосфата калия, взаимодействием одного моля (недостаток) карбоната калия (сода – поташ) с фосфорной кислотой.
2H3PO4 + K2CO3 = 2 KH2PO4 + CO2  + H2O
+ H2O
Соли, в которых остаётся катион водорода кислоты, называются
кислыми солями:
- эмульгатор в пищевой промышленности – гидрофосфат натрия Na2HPO4
- почвенное удобрение - дигидрофосфат аммония NH4H2PO4
Круговорот фосфора в природе:
- 13 место по распространённости;
- апатиты (фосфат кальция), фосфориты - минералы фосфора (много на Кольском полуострове);
-усваивается растениями в виде растворов, полученных из-за выветривания, окисления и деятельности бактерий;
-попадает с растительной пищей в организм животных
- «элемент мысли» входит в состав нейронов, АТФ, нуклеиновых кислот- ДНК и РНК, клеточных мембран
- отмирание растений и животных – фосфор возвращается в природу
Применение фосфора:
-производство спичек
- фосфатирование лучших сортов стали
- фармацевтика
- фосфорные удобрения
Решить цепочки превращений:
1. Фосфор —> пентаоксид фосфора —> ортофосфорная кислота —> фосфат кальция —>фосфорная кислота.
2.Фосфат кальция —> фосфор —> фосфид кальция —> фосфин —> пентаоксид фосфора —> фосфорная кислота —> дигидрофосфат кальция.
Тест «Фосфор и его соединения».
1. Исключите «лишний» элемент из перечисленных по принципу возможности образования аллотропных модификаций:
а) кислород; б) азот; в) фосфор; г) сера.
2. При взаимодействии 42,6 г фосфорного ангидрида и 400 г 15%-го раствора гидроксида натрия образуется:
а) фосфат натрия;
б) гидрофосфат натрия;
в) смесь фосфата и гидрофосфата натрия;
г) смесь гидро- и дигидрофосфата натрия.
3. Сумма коэффициентов в уравнении электролитической диссоциации фосфата калия равна: а) 5; б) 3; в) 4; г) 8.
4. Число электронов на внешнем уровне атома фосфора: а) 2; б) 3; в) 5; г) 15.
5. Фосфор, полученный из 33 г технического фосфата кальция, сожгли в кислороде. Образовавшийся оксид фосфора(V) прореагировал с 200 мл 10%-го раствора гидроксида натрия (плотность – 1,2 г/мл) с образованием средней соли. Масса примесей в техническом образце фосфата кальция (в г) составляет: а) 3,5; б) 1,5; в) 2; г) 4,8.
6. Число атомов водорода, содержащихся в 4,48 л (н.у.) фосфина равно:
а) 1,2•1023; б) 0,6•1023;
в) 6,02•1023; г) 3,6•1023.
7. Ортофосфорная кислота может реагировать со следующими веществами:
а) оксид меди(II); б)гидроксид калия;
в) азотная кислота; г) цинк.
8. Сумма коэффициентов в реакции между фосфором и бертолетовой солью равна: а) 9; б) 6; в) 19; г) такая реакция невозможна.