Применение кислорода
Применение кислорода в практической деятельности человека чрезвычайно широко. Чистый кислород и его смесь с углекислым газом используют при ослаблении дыхания в послеоперационном периоде, при отравлениях, интоксикациях организма и т. п.
Также кислород применяют под повышенным давлением для так называемой гипербарической оксигенации. Установлена высокая эффективность этого метода при лечении различных заболеваний, в частности с использованием специальных барокамер (рис. 20.4).
Для улучшения обменных процессов при кислородной недостаточности организма используют кислородные коктейли. Коктейль обычно готовят пропусканием под небольшим давлением кислорода в виде мелких пузырьков через белок куриного яйца. В полученную пену часто добавляют настои шиповника и других лекарственных растений, глюкозу, витамины.
Следует отметить, что длительное вдыхание воздуха, обогащенного кислородом, опасно для здоровья человека. Высокие концентрации кислорода влекут за собой вредные изменения в живых тканях.
| Рис. 20.4. Барокамеры |

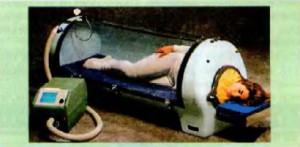
|
| Рис. 20.5. Гипобарическая камера |
Кислород широко применяют не только для повышения насыщения им тканей организма и борьбы с гипоксией. В последнее время в медицинских целях используют газовые смеси со сниженным содержанием кислорода для создания его искусственной нехватки.
Установлено, что специальными тренировками при кислородной недостаточности может быть выработана повышенная устойчивость организма к разным неблагоприятным факторам внешней и внутренней среды. Ведь жители горных районов не страдают от кислородной недостаточности. Их организм приспособился к экстремальным условиям: интенсивнее происходят процессы кровообращения, организм производит больше гемоглобина.
Баллоны, которые используют для обеспечения дыхания космонавтов, летчиков, водолазов, аквалангистов, пожарников и т. п., содержат кислород.
Медленное окисление веществ еды в нашем организме — «энергетическая база» жизни. А тепловую энергию, которая выделяется при окислении мусора и перегноя, используют для обогрева парников и коттеджей.
Применяют кислород и в полеводстве. Один из эффективных способов предпосевной подготовки семян — намачивание в насыщенной кислородом воде. Это мероприятие убыстряет прорастание семян и повышает их полевую всхожесть.
Важную роль играет кислород в промышленности. Обогащение воздуха кислородом убыстряет технологические процессы, связанные с окислением веществ. Они — основа тепловой энергетики и металлургии. Ведь превращение чугуна в сталь, обжиг руд цветных металлов невозможно осуществить без применения кислорода.
Кислород используют и для получения высоких температур. Для этого разные горючие газы (водород, ацетилен, метан) сжигают в специальных горелках.
Смеси жидкого кислорода с угольным порошком, древесной мукой или другими горючими веществами называют оксиликвитами. Их очень сильные взрывные свойства применяют на подрывных работах.
Жидкий кислород — эффективный окислитель ракетного топлива.
Круговорот кислорода в природе
Кислород является самым распространенным элементом земной коры. В атмосфере его находится около 23% (масс.), в составе воды – около 89%, в человеческом организме – около 65%, в песке содержится 53% кислорода, в глине – 56% и т.д. Если подсчитать его количество в воздухе (атмосфере), воде (гидросфере) и доступной непосредственному химическому исследованию части твердой земной коры (литосфере), то окажется, что на долю кислорода приходится примерно 50% их общей массы. Свободный кислород содержится почти исключительно в атмосфере, причем количество его оценивается в 1200000000000000 т. При всей громадности этой величины она не превышает 0,0001 общего содержания кислорода в земной коре.
В связанном состоянии кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, встречающиеся в земной коре, содержат кислород. Кислород является составной частью многих органических соединений, например белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека.
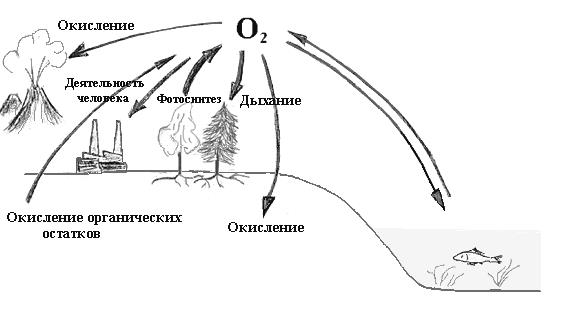
Круговорот кислорода в природе – это процесс обмена кислородом, который происходит между атмосферой, гидросферой и литосферой. Основным источником возобновления кислорода на Земле служит фотосинтез – процесс, происходящий в растениях за счет поглощения ими углекислого газа. Растворенный в воде кислород поглощается водными формами жизни посредством дыхания.
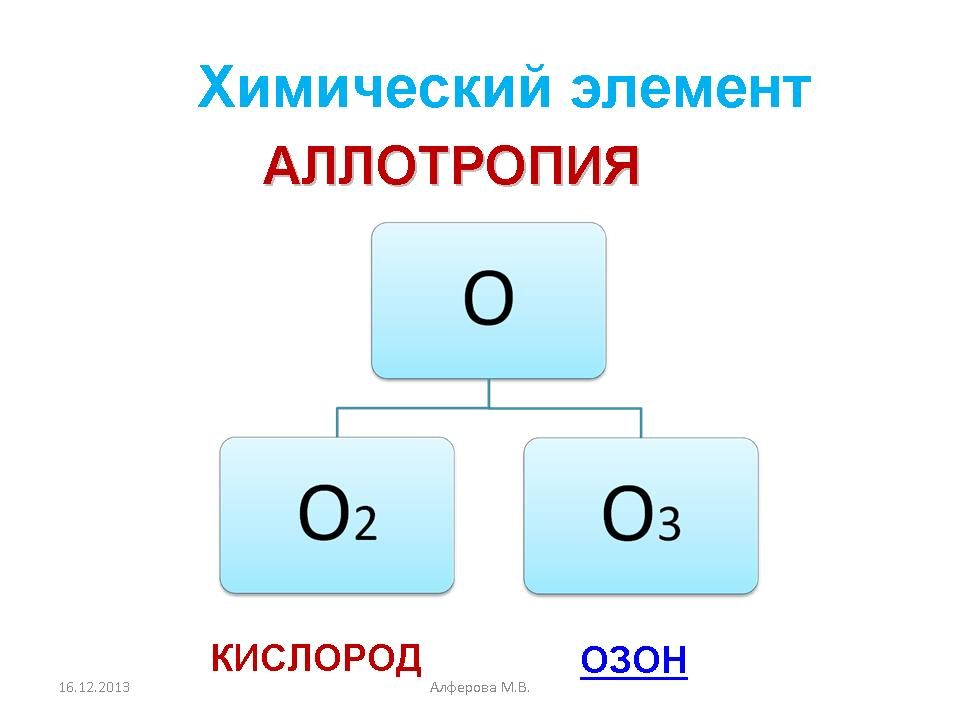
Аллотропия кислорода
Аллотро́пия (от др. -греч. αλλος — «другой», τροπος — «поворот, свойство») — существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных (или аллотропических) модификаций или форм.
Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов; одновременно он предполагал, по-видимому, применить его и к изомерии соединений. После принятия гипотезы А. Авогадро в 1860 году стало понятно, что элементы могут существовать в виде многоатомных молекул, например, О2 — кислород и О3 — озон.
Аллотропные видоизменения кислорода насчитывают всего одну модификацию – озон.
При пропускании электрических искр через кислород или воздух появляется характерный запах, причиной которого является образование нового вещества – озона. Озон можно получить из совершенно чистого сухого кислорода; отсюда следует, что он состоит только из кислорода и представляет собой его аллотропическое видоизменение.
Молекулярная масса озона равна 48. Атомная же масса кислорода равна 16; следовательно, молекула озона состоит из трех атомов кислорода — О3.
Для получения озона пользуются действием тихих электрических разрядов на кислород. Приборы, служащие для этой цели называют озонаторами.
При обычных условиях озон – газ. От кислорода его можно отделить сильным охлаждением; озон конденсируется в синюю жидкость, кипящую при 111,9 градусах цельсия.
Растворимость озона в воде значительно больше, чем кислорода: 100 объемов воды при растворяют 49 объемов озона.
Образование озона из кислорода можно выразить уравнением:
Обратная же реакция – распад озона – протекает самопроизвольно, так как в ходе этого процесса энергия Гиббса системы уменьшается. Иначе говоря, озон – неустойчивое вещество.
Молекула озона построена в форме равнобедренного треугольника. Близость угла, при вершине которого к указывает на то, что центральный атом кислорода находится в состоянии — гибридизации.
Список использованной литературы:
Учебник за 9 класс по химии О.С. Габриелян.
Энциклопедия по химии.
Интернет <Популярная библиотека химических элементов>.
Начало формы
Конец формы
Путешествие по шестой группе. Элементы шестой группы периодической системы Мендилеева. Пособие для учащихся Г.Л. Немчинова1976 год
Книга для чтения по неорганической химии В.А. Карцмана