Тема. Глюкоза.
Вспомните, какими способами можно получить глюкозу.
а) Реакция фотосинтеза
6СО2 + 6H2O –> С6Н12 О6 + 6О2 +Q
б) Реакция полимеризации
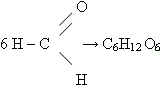
в) Гидролиз крахмала (уравнение записывает учитель)
(С6Н10О5)n + nH2O –> nС6Н12О6
Глюкоза – альдегидоспирт, точнее – многоатомный альдегидоспирт.
Установлено, что в растворе глюкозы находится не только её альдегидная форма; но и молекулы циклического строения.
Установлено, что у третьего атома углерода группа – ОН расположена иначе, чем у других атомов углерода распространённое строение глюкозы выглядит так:
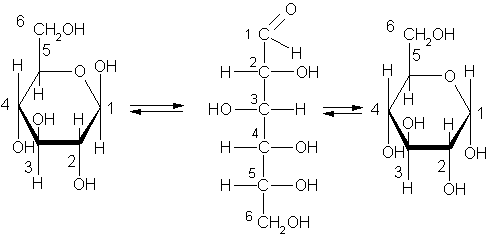
Превращение молекулы линейного строения в молекулу циклического строения объяснимо, если вспомнить что атомы углерода могут вращаться вокруг 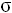 -связей. Альдегидная группа может приблизиться к гидроксильной группе 5-го атома углерода, поскольку атом кислородакарбонильной группы несёт на себе частичный – заряд, а атом водород гидроксильной группы – частично + заряд.
-связей. Альдегидная группа может приблизиться к гидроксильной группе 5-го атома углерода, поскольку атом кислородакарбонильной группы несёт на себе частичный – заряд, а атом водород гидроксильной группы – частично + заряд.
Осуществляется своеобразный химический процесс: происходит разрыв 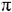 -связи карбонильной труппы, к атому кислорода присоединяется атом водорода, а атом кислорода гидроксильной группы с атомом углерода замыкают цепь. Циклические формы находятся в равновесии, превращаясь
-связи карбонильной труппы, к атому кислорода присоединяется атом водорода, а атом кислорода гидроксильной группы с атомом углерода замыкают цепь. Циклические формы находятся в равновесии, превращаясь 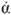 и
и 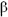 форму. Таким образом, в водном растворе глюкозы находятся три изомерные формы. Молекула кристаллической глюкозы
форму. Таким образом, в водном растворе глюкозы находятся три изомерные формы. Молекула кристаллической глюкозы 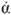 - форма, при растворении в воде – открытая форма, а затем снова циклическая
- форма, при растворении в воде – открытая форма, а затем снова циклическая 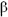 -форма. Такая изомерия называется динамической (таутомерия).
-форма. Такая изомерия называется динамической (таутомерия).
Физические свойства: бесцветное кристаллическое вещество, хорошо растворимо в воде, сладкое на вкус, температура плавления 146оС.
Химические свойства глюкозы: окисление в глюконовую кислоту, восстановление в сорбит, спиртовое брожение.
Раствор глюкозы дает две качественные реакции: «Наличие каких функциональных групп можно предположить в структурной формуле глюкозы?».
Глюкоза является веществом с двойственными свойствами – альдегидоспиртом. Демонстрация реакции «серебряного зеркала».
I. Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
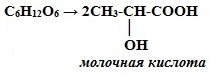
3. Маслянокислое брожение:
C6H12O6 → C3H7COOH + 2H2 ↑+ 2CO2↑
II. Свойства альдегидов
1. Реакция серебряного зеркала:
Видео «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓
или
СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 + H2O
СH2OH(CHOH)4-COOH - глюконовая кислота
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный
3. Восстановление:
СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4-CH2OH
сорбит – шестиатомный спирт
III. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
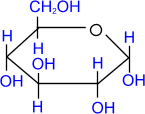 α - глюкоза
α - глюкоза
| + СH3ОН | HCl(газ)→ | 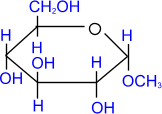
| + H2О |
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
«Качественная реакция глюкозы с гидроксидом меди (II)»
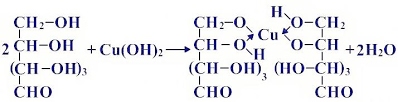
(глюкозат меди (II) – синий раствор)