ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ НАУЧНОЕ УЧРЕЖДЕНИЕ
«ФЕДЕРАЛЬНЫЙ ИНСТИТУТ ПЕДАГОГИЧЕСКИХ ИЗМЕРЕНИЙ»
Методические материалы для председателей и членов предметных комиссий субъектов Российской Федерации
По проверке выполнения заданий с развёрнутым ответом экзаменационных работ ЕГЭ 2022 года
ХИМИЯ
Москва
Автор-составитель: Д.Ю. Добротин
Методические материалы для председателей и членов предметных комиссий субъектов Российской Федерации по проверке выполнения заданий с развёрнутым ответом экзаменационных работ ЕГЭ 2022 г. по химии подготовлены в соответствии с Тематическим планом работ федерального государственного бюджетного научного учреждения «Федеральный институт педагогических измерений» на 2022 г. Пособие предназначено для подготовки экспертов по оцениванию выполнения заданий с развёрнутым ответом, которые являются частью контрольных измерительных материалов (КИМ) для сдачи единого государственного экзамена (ЕГЭ) по химии.
В методических материалах даётся краткое описание структуры контрольных измерительных материалов 2022 г. по химии, характеризуются типы заданий с развёрнутым ответом, используемые в КИМ ЕГЭ по химии, и критерии оценки выполнения заданий с развёрнутым ответом, приводятся примеры оценивания выполнения заданий и даются комментарии, объясняющие выставленную оценку.
Авторы будут благодарны за замечания и предложения по совершенствованию пособия.
© Д.Ю. Добротин, М.Г. Снастина, 2022
© Федеральный институт педагогических измерений, 2022
ОГЛАВЛЕНИЕ
1. Задания с развёрнутым ответом в структуре КИМ ЕГЭ 2022 года по химии. 4
|
|
2. Методика оценивания заданий с развёрнутым ответом (основные подходы к определению критериев и шкалы оценивания выполнения заданий) 6
Задание 29. 7
Задание 30. 8
Задание 31. 9
Задание 32. 10
Задание 33. 11
Задание 34. 13
Примеры оценивания ответов на задания 29–34. 15
Задание 29. 15
Задание 30. 16
Задание 31. 18
Задание 32. 20
Задание 33. 22
Задание 34. 28
Приложение 1. Обобщенный план варианта КИМ ЕГЭ 2022 года по химии……………………………………………………………………………………………………………….32
Приложение 2. Извлечения из Методических рекомендаций Рособрнадзора по формированию и организации работы предметных комиссий
субъекта Российской Федерации при проведении государственной итоговой аттестации
по образовательным программам среднего общего образования. 40
1. Задания с развёрнутым ответом в структуре КИМ ЕГЭ 2022 года по химии
Содержание и структура контрольных измерительных материалов (КИМ) определяются целью единого государственного экзамена (ЕГЭ): обеспечением объективной оценки качества подготовки лиц, освоивших образовательные программы среднего (полного) общего образования, с использованием заданий стандартизированной формы.
Задания с развёрнутым ответом единого государственного экзамена по химии предусматривают комплексную проверку усвоения на высоком уровне сложности нескольких (двух и более) элементов содержания из различных содержательных блоков курса по общей, неорганической и органической химии. Наряду с тем, что они комплексно проверяют усвоение наиболее важных элементов из содержательных блоков «Теоретические основы химии» (содержательная линия «Химическая реакция»), «Методы познания в химии. Химия и жизнь», эти задания ориентированы на проверку умений, отвечающих требованиям образовательного стандарта профильного уровня:
|
|
− объяснять обусловленность свойств и применения веществ их составом и строением, характер взаимного влияния атомов в молекулах органических соединений, взаимосвязь неорганических и органических веществ, сущность и закономерность протекания изученных типов реакций;
− проводить комбинированные расчёты по химическим уравнениям.
Комбинирование проверяемых элементов содержания в заданиях с развёрнутым ответом осуществляют таким образом, чтобы уже в их условии была обозначена необходимость: последовательного выполнения нескольких взаимосвязанных действий, выявления причинно-следственных связей между элементами содержания, формулирования ответа в определённой логике и с аргументацией отдельных положений. Отсюда становится очевидным, что выполнение заданий с развёрнутым ответом требует от выпускника прочных теоретических знаний, а также сформированных умений применять эти знания в различных учебных ситуациях, последовательно и логично выстраивать ответ, делать выводы и заключения, приводить аргументы в пользу высказанной точки зрения и т.п.
Задания с развёрнутым ответом, предлагаемые в экзаменационной работе, имеют различную степень сложности и предусматривают проверку от двух до пяти элементов ответа. Каждый отдельный элемент ответа оценивается в 1 балл, поэтому максимальная оценка верно выполненного задания составляет от 2 до 5 баллов (в зависимости от числа элементов ответа, предусмотренных условием задания).
|
|
Проверка заданий осуществляется экспертом на основе анализа выполнения задания экзаменуемым и выявления элементов ответа, обозначенных в критериях оценивания задания.
Важно принимать во внимание, что содержание заданий с развёрнутым ответом во многих случаях может ориентировать экзаменуемых на использование различных способов их выполнения. Это относится прежде всего к способам решения расчётных задач. Поэтому указания по оцениванию выполнения заданий следует рассматривать применительно к варианту ответа, предложенному экзаменуемым.
Все перечисленные выше особенности заданий с развёрнутым ответом позволяют сделать вывод, что они предназначены для проверки владения умениями, которые отвечают наиболее высоким требованиям к уровню подготовки выпускников, и могут служить эффективным средством дифференцированного оценивания достижений каждого из них.
Основные элементы содержания,
проверяемые заданиями с развёрнутым ответом
При отборе содержания для заданий с развёрнутым ответом в первую очередь учитывается, какие элементы содержания и умения являются наиболее важными и отвечающими требованиям образовательного стандарта профильного уровня к подготовке выпускников средней (полной) школы. К таким элементам содержания, в частности, были отнесены: окислительно-восстановительные реакции, реакции ионного обмена, состав и строение веществ, взаимное влияние атомов в молекулах, механизмы протекания реакций, генетическая связь между классами неорганических и органических соединений, вычисления по химическим формулам и уравнениям реакций.
При выполнении заданий экзаменуемый должен продемонстрировать понимание сущности единства мира веществ, механизмов протекания реакций, умение составлять уравнения реакций и объяснять механизмы их протекания, применять знания о свойствах веществ различных классов, особенностях строения веществ и др. Большая роль отведена расчётным задачам по химии. Это объясняется тем, что при их решении необходимо опираться на знание химических свойств соединений, использовать умение составлять уравнения химических реакций, т.е. использовать во взаимосвязи теоретическую базу и определённые операционно-логические и вычислительные навыки.
В экзаменационной работе используются задания, связанные с выполнением всех видов химических расчётов, которые представлены в учебных программах не только для средней, но и для основной школы (см. приложение 1).
Изменения структуры и содержания в части 2 экзаменационной работы 2022 г. по химии в сравнении с экзаменационной моделью 2021 г. отсутствуют.
2. Методика оценивания заданий с развёрнутым ответом
(основные подходы к определению критериев
и шкалы оценивания выполнения заданий)
Основу методики оценивания заданий с развёрнутым ответом составляет ряд общих положений. Наиболее важными в их числе являются следующие.
· Проверка и оценивание заданий с развёрнутым ответом осуществляется только путём независимой экспертизы на основе метода поэлементного анализа ответов экзаменуемых.
· Применение метода поэлементного анализа делает необходимым обеспечение чёткого соответствия формулировки условия задания проверяемым элементам содержания. Перечень элементов содержания, проверяемых любым заданием, согласуется с требованиями стандарта к уровню подготовки выпускников средней школы.
· Для оценивания выполнения задания методом поэлементного анализа требуется установить наличие в ответах экзаменуемых элементов ответа, обозначенных в критериях оценивания задания. Должна быть принята и оценена любая модель ответа, предложенная экзаменуемым, если она не искажает сути химической составляющей условия задания.
Шкала оценивания выполнения задания устанавливается в зависимости от числа элементов ответа, указанных в критериях оценивания ответа, и с учётом таких факторов, как:
· уровень сложности проверяемого содержания;
· определённая последовательность действий, которые следует осуществить при выполнении задания;
· однозначность трактовки условия задания и возможных вариантов формулировок ответа;
· соответствие условия задания предлагаемым критериям оценивания по отдельным элементам содержания.
При разработке критериев оценивания учитываются особенности элементов содержания всех шести заданий с развёрнутым ответом, включённых в экзаменационную работу. Принимается во внимание и то, что записи ответов экзаменуемых могут быть как очень общими, обтекаемыми и неконкретными, так и излишне краткими и недостаточно аргументированными. Пристальное внимание уделяется выделению элементов ответа, оцениваемых в 1 балл. При этом учитывается неизбежность постепенного повышения трудности получения каждого последующего балла за правильно сформулированный элемент ответа.
При составлении шкалы оценивания расчётных задач (33 и 34) учитывается возможность различных путей их решения, а следовательно, присутствие в ответе экзаменуемого основных этапов и результатов выполнения заданий, указанных в критериях оценивания.
В 2022 г. перед критериями оценивания каждого из вариантов включена следующая дополнительная общая инструкция-установка.
При наличии уравнений химических реакций, отражающих дополнительные/ альтернативные химические превращения, не противоречащие условиям заданий, а также соответствующих им расчётов (в заданиях 33 и 34) эксперт оценивает правильность представленного экзаменуемым решения в соответствии со шкалой и критериями оценивания.
В ней подчёркивается, что при оценивании альтернативного варианта решения задания эксперт выявляет в нём элементы решения и соотносит их с предложенными критериями и шкалой оценивания.
Проиллюстрируем методику оценивания заданий с развёрнутым ответом на конкретных примерах.
Задание 29
Для выполнения заданий 29 и 30 экзаменуемым предлагается общий список из шести веществ, при этом в условии уточняется, что при необходимости экзаменуемые могут применить и растворы этих веществ.
Задания линии 29 ориентированы на проверку умения составлять уравнения окислительно-восстановительных реакций. Для выполнения задания экзаменуемому необходимо осуществить ряд последовательных действий: проанализировать состав веществ из списка, выбрать вещества, которые могут проявлять свойства окислителя и восстановителя в реакции; по представленным в условии классификационным признакам веществ и/или признакам протекания химических реакций определить продукты реакции; составить электронный баланс реакции и на его основе расставить коэффициенты в уравнении реакции; определить окислитель и восстановитель в составленном уравнении реакции. С учётом такой последовательности действий были определены следующие элементы ответа:
· выбраны вещества, которые являются окислителем и восстановителем, и записано молекулярное уравнение окислительно-восстановительной реакции;
· составлен электронный баланс реакции, указаны окислитель и восстановитель.
Пример задания
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование воды в качестве среды протекания реакции.
| 29 |
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделения осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы | ||
Вариант ответа
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
Сульфит натрия (или сера в степени окисления +4) является восстановителем. Перманганат калия (или марганец в степени окисления +7) – окислителем | |||
| Ответ правильный и полный, содержит следующие элементы: · выбраны вещества, и записано уравнение окислительно-восстановительной реакции; · составлен электронный баланс, указаны окислитель и восстановитель | |||
| Правильно записан один элемент ответа | |||
| Все элементы ответа записаны неверно | |||
| Максимальный балл | 2 |
Примечание. Если молекулярное уравнение реакции не соответствует условию задания или в нём неверно определены продукты реакции, то электронный баланс не оценивается (выставляется 0 баллов).
При оценивании ответа экзаменуемого необходимо учитывать, что из списка веществ могут быть выбраны не только те вещества, которые представлены в «варианте ответа», но при этом составленное уравнение реакции должно в полной мере учитывать все требования, которые предъявляются к реакции: признак(и) протекания реакции и/или классификационный(-ые) признак(и) выбранных веществ. В данном задании следует учитывать, что продуктами реакции должны быть соль и кислота. Дополнительный фильтр указывает на отсутствие осадка. Нарушение любого из требований должно оцениваться как ошибка. Необходимо также учитывать, что единых требований к оформлению ответа на задание 29 не предъявляется. Вследствие этого в качестве верного ответа принимается составление как электронного, так и электронно-ионного баланса реакции, а также указание окислителя и восстановителя любыми однозначно понятными способами. Однако если в ответе содержатся взаимоисключающие по смыслу суждения, то такие элементы ответа не могут считаться верными.
Задание 30
Задания 30 ориентированы на проверку умения составлять уравнения реакций ионного обмена. Реакции ионного обмена протекают между электролитами в направлении связывания ионов. Чтобы выполнить это задание, экзаменуемым необходимо выбрать из предложенного списка вещества, между которыми протекает реакция ионного обмена, а также показать понимание механизма реакции, составив полное и сокращённое ионное уравнения. Так же как и в задании 29, в условие включено уточнение, сужающее вариативность выбора веществ, взаимодействие которых удовлетворяет условию задания. В этом качестве может выступать классификационный признак веществ(а), участвующих в реакции, и/или признак(и) протекания реакции.
Пример задания
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование воды в качестве среды протекания реакции.
| 30 |
Из предложенного перечня веществ выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Вариант ответа 2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O 2Na+ + 2HCO3– + 2K+ + 2OH– = 2Na+ + 2K+ + 2CO32– + 2H2O HCO3– + OH– = CO32– + H2O | |
| Ответ правильный и полный, содержит следующие элементы: · выбраны вещества, и записано молекулярное уравнение реакции ионного обмена; · записаны полное и сокращённое ионное уравнения реакции | |
| Правильно записан один элемент ответа | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 2 |
Как и при проверке выполнения задания 29, необходимо учитывать, что экзаменуемые могут выбрать из списка и другие вещества, между которыми возможна реакция ионного обмена. При оценивании записи ионных уравнений реакций необходимо учитывать правильность записи зарядов ионов и их значений, записи формул веществ для электролитов и неэлектролитов, а также наличие минимальных коэффициентов в сокращённом ионном уравнении.
Как и в задании 29, при выборе веществ необходимо учитывать указанные в условии требования, например: выделяется газ, а осадок не образуется. При оценивании выполнения заданий необходимо учитывать все требования, предъявляемые к оформлению ответа.
Задание 31
В условии задания 31, проверяющего знание генетической взаимосвязи различных классов неорганических веществ, предложено описание конкретного химического эксперимента, ход которого экзаменуемые должны проиллюстрировать уравнениями соответствующих химических реакций. Шкала оценивания задания равна 4 баллам: каждое верно записанное уравнение реакции оценивается в 1 балл.
Пример задания
При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия.
Напишите уравнения четырёх описанных реакций.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Вариант ответа: Ответ включает в себя четыре уравнения возможных реакций, соответствующих описанным превращениям: 1) 2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз) 2) Cu + 2H2SO4(конц.) = CuSO4 + SO2↑ + 2H2O 3) SO2 + 2H2S = 3S + 2H2O 4) 3S + 6KOH = 2K2S + K2SO3 + 3H2O (возможно образование K2S2O3) | |
| Правильно записаны четыре уравнения реакций | |
| Правильно записаны три уравнения реакций | |
| Правильно записаны два уравнения реакций | |
| Правильно записано одно уравнение реакции | |
| Все уравнения реакций записаны неверно | |
| Максимальный балл | 4 |
Уравнение реакции считается записанным верно, если правильно записаны все формулы веществ – участников реакции, присутствуют все коэффициенты, продукты реакции соответствуют условиям проведения реакции.
Задание 32
Задания 32 проверяют усвоение знаний о взаимосвязи органических веществ и предусматривают наличие пяти элементов ответа – пяти уравнений реакций, соответствующих схеме («цепочке») превращений органических веществ. В приведённой схеме могут указываться также условия осуществления этих превращений, которые оказывают влияние на состав образующихся продуктов. При записи уравнений реакций экзаменуемые должны использовать структурные формулы органических веществ разного вида (развёрнутую, сокращённую, скелетную), которые однозначно отражают порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Наличие каждого проверяемого элемента ответа оценивается в 1 балл. Максимальное количество баллов за выполнение таких заданий равно 5.
Пример задания
| 32 |
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
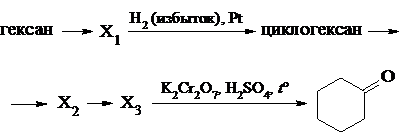
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Вариант ответа
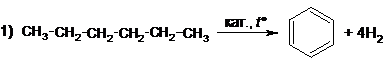
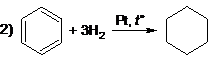
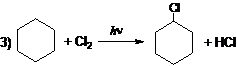 (возможна реакция бромирования) (возможна реакция бромирования)
| |
| Правильно записаны пять уравнений реакций | |
| Правильно записаны четыре уравнения реакций | |
| Правильно записаны три уравнения реакций | |
| Правильно записаны два уравнения реакций | |
| Правильно записано одно уравнение реакции | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 5 |
Примечание. Допустимо использование структурных формул разных видов (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Отметим, что к уравнениям реакций предъявляются всё те же требования, что и при выполнении задания 31. В случае, если в ответе экзаменуемого есть несоответствие условий проведения реакции и состава образующихся продуктов, такой элемент ответа считается неверным (наличие взаимоисключающих суждений).
Задание 33
Задания 33 – это расчётные задачи. Их выполнение требует знания химических свойств веществ и предполагает осуществление некоторой совокупности действий, обеспечивающей получение правильного ответа. В числе таких действий назовём следующие:
− составление уравнений химических реакций (согласно данным условия задачи), необходимых для выполнения стехиометрических расчётов;
− выполнение расчётов, необходимых для нахождения ответов на поставленные в условии задачи вопросы;
− формулирование логически обоснованного ответа на все поставленные в условии задания вопросы (например, определить физическую величину – массу, объём, массовую долю вещества).
Однако следует иметь в виду, что не все названные действия обязательно должны выполняться при решении любой расчётной задачи, а в отдельных случаях некоторые из них могут использоваться неоднократно.
Максимальная оценка за выполнение задания составляет 4 балла. При проверке следует в первую очередь обращать внимание на логическую обоснованность выполненных действий, поскольку некоторые задачи могут быть решены несколькими способами. Вместе с тем в целях объективной оценки предложенного способа решения задачи необходимо проверять правильность промежуточных результатов, которые использовались для получения ответа.
Пример задания
| 33 |
Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция составляет 50%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 330 г. Один из выделившихся газов был поглощён 400 г 4%-ного раствора гидроксида натрия. Вычислите массовую долю соли в образовавшемся после поглощения газа растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Вариант ответа Записаны уравнения реакций: [1] Ca + 2HCl = CaCl2 + H2 [2] CaCO3 + 2HCl = CaCl2 + CO2 + H2O [3] CO2 + NaOH = NaHCO3 Рассчитаны количество вещества реагентов и массы продуктов реакций: Δm(р-ра) = 330 – 300 = 30 г Пусть в исходной смеси n(Ca) = х моль n(CaCO3) = y моль Тогда: Δm(р-ра) = 40 х + 100 у – 2 х – 44 у = 30 г w(Ca) = 40(х + у) / (40 x + 100 у) = 0,5 n(Ca) = x = 0,2 моль n(CaCO3) = y = 0,4 моль n(CO2) = n(CaCO3) = 0,4 моль m(CO2) = 0,4 ∙ 44 = 17,6 г m(NaOH) = 400 ∙ 0,04 = 16 г n(NaOH) = 16 / 40 = 0,4 моль n(NaHCO3) = n(NaOH) = 0,4 моль m(NaHCO3) = 0,4 ∙ 84 = 33,6 г Вычислена массовая доля соли в растворе: m(р-ра) = 400 + 17,6 = 417,6 г w(NaHCO3) = 33,6 / 417,6 = 0,08, или 8% |
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Ответ правильный и полный, содержит следующие элементы: · правильно записаны уравнения реакций, соответствующих условию задания; · правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания; · продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которой проводятся расчёты; · в соответствии с условием задания определена искомая физическая величина | |
| Правильно записаны три элемента ответа | |
| Правильно записаны два элемента ответа | |
| Правильно записан один элемент ответа | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 4 |
Примечание. В случае, когда в ответе содержится ошибка в вычислениях, которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
Задание 34
Задание 34 предусматривает определение молекулярной и структурной формулы органического вещества. Выполнение этого задания включает следующие последовательные действия: определение молекулярной формулы вещества на основании вычислений с использованием физических величин, заданных в условии задачи; установление структуры вещества по указанным свойствам или способам получения этого вещества; составление уравнения реакции, указанного в условии задания. С учётом этих действий максимальная оценка за выполнение задания 34 составляет 3 балла.
Пример задания
При сгорании органического вещества А массой 3,4 г получено 4,48 л (н.у.) углекислого газа и 1,8 г воды. Известно, что вещество А вступает в реакцию с раствором гидроксида лития при нагревании, в результате чего образуется предельный одноатомный спирт и соль, кислотный остаток которой содержит семь атомов углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с раствором гидроксида лития при нагревании (используйте структурные формулы органических веществ).
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Вариант ответа
Проведены необходимые вычисления, и найдена молекулярная формула вещества А:
n(CO2) = 4,48 / 22,4 = 0,2 моль; n(С) = 0,2 моль
n(H2O) = 1,8 / 18 = 0,1 моль; n(H) = 0,1 ∙ 2 = 0,2 моль
m(C + H) = 0,2 ∙ 12 + 0,2 ∙ 1 = 2,6 г
m(О) = 3,4 – 2,6 = 0,8 г
n(O) = 0,8 / 16 = 0,05 моль
n(С): n(Н): n(O) = 0,2: 0,2: 0,05 = 4: 4: 1
Молекулярная формула – C8H8O2
Приведена структурная формула вещества А:
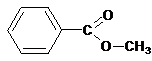 Составлено уравнение реакции с раствором гидроксида лития:
Составлено уравнение реакции с раствором гидроксида лития:
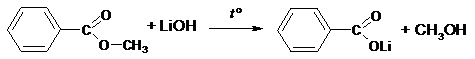
| |
| Ответ правильный и полный, содержит следующие элементы: · правильно произведены вычисления, необходимые для установления молекулярной формулы вещества, и записана молекулярная формула вещества; · записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; · с использованием структурной формулы органического вещества записано уравнение реакции, на которую даётся указание в условии задания | |
| Правильно записаны два элемента ответа | |
| Правильно записан один элемент ответа | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 3 |
Обратим внимание на то, что в ответах не всегда присутствует как отдельный элемент запись структурной формулы вещества. Но в уравнении реакции, о которой говорится в условии задания, структурная формула имеется. В этом случае рекомендуется выставлять балл за определение структурной формулы вещества.
Примеры оценивания ответов на задания 29–34
Задание 29

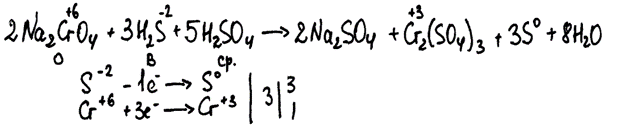
Комментарий
Использовано вещество, отсутствующее в предложенном перечне (хромат вместо дихромата натрия). Первый элемент ответа оценивается 0 баллов. Второй элемент ответа не проверяется и не оценивается, да и в электронном балансе допущена ошибка.
Итого: 0 баллов.
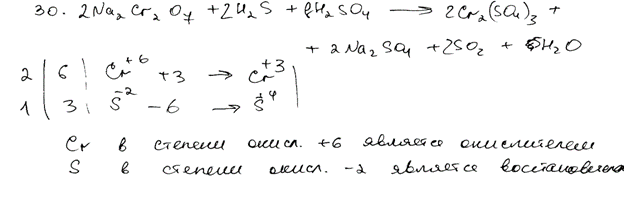
Комментарий
Использованы вещества из предложенного перечня. Приведённое уравнение реакции не соответствует условию задания: образовался газ, а не простое вещество.
Итого: 0 баллов.
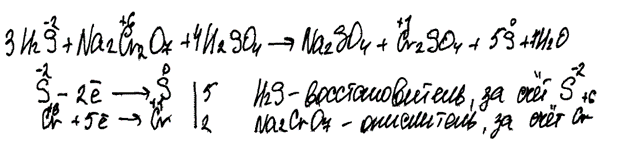
Комментарий
Использованы вещества из предложенного перечня. В уравнении реакции есть ошибка в формуле продукта реакции. Электронный баланс составлен неверно; окислитель и восстановитель указаны верно. Оба элемента ответа выполнены с ошибками.
Итого: 0 баллов.
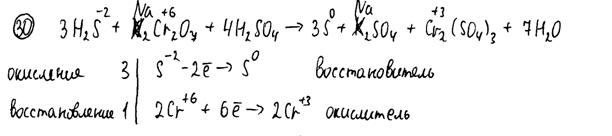
Комментарий
Использованы вещества из предложенного перечня. В молекулярном уравнении реакции ошибок нет. Электронный баланс составлен верно; окислитель и восстановитель указаны верно.
Итого: 2 балла.
Задание 30
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфид серебра(I), азотная кислота, перманганат калия, сульфат аммония, ацетат стронция, нитрат железа(III). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми сопровождается образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Вариант ответа (CH3COO)2Sr + (NH4)2SO4 = SrSO4 + 2CH3COONH4 2CH3COO– + Sr2+ + 2NH4+ + SO42– = SrSO4 + 2CH3COO– + 2NH4+ Sr2+ + SO42– = SrSO4 | |
| Ответ правильный и полный, содержит следующие элементы: • выбраны вещества, и записано молекулярное уравнение реакции ионного обмена; • записаны полное и сокращённое ионное уравнения реакции | |
| Правильно записан один элемент ответа | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 2 |
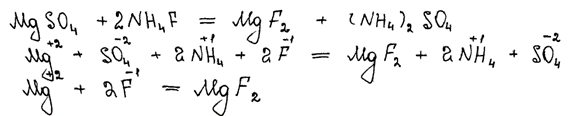
Комментарий
Использованы вещества из предложенного перечня. Приведённое молекулярное уравнение реакции соответствует условию задания. В ионных уравнениях неверно записаны заряды ионов.
Итого: 1 балл.
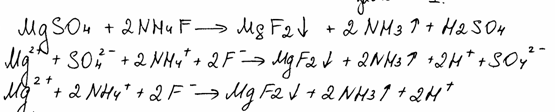
Комментарий
Использованы вещества из предложенного перечня. Ошибка в записи формул продуктов реакций.
Итого: 0 баллов.
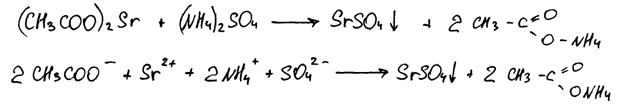
Комментарий
Использованы вещества из предложенного перечня. Приведённое уравнение реакции соответствует условию задания. Полное ионное уравнение составлено с ошибкой.
Итого: 1 балл
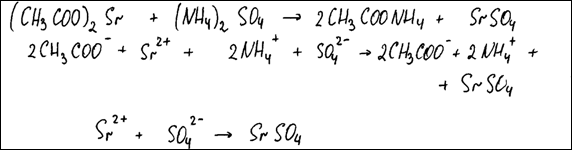
Комментарий
Молекулярное уравнение реакции составлено верно, в соответствии с условием задания. Полное и сокращённое ионные уравнения реакции также составлены верно.
Итого: 2 балла.
Задание 31
Нитрат меди(II) прокалили. Образовавшуюся при этом смесь газов пропустили через воду, при этом образовалась кислота. В горячий концентрированный раствор этой кислоты поместили оксид железа(II). Образовавшуюся соль железа выделили и поместили в раствор карбоната калия.
Напишите уравнения четырёх описанных реакций.
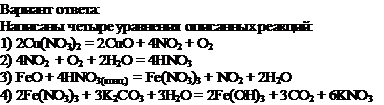
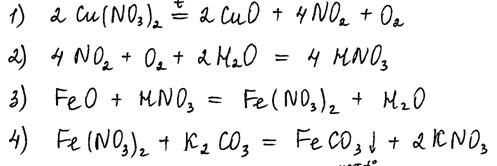
Комментарий
Ошибки допущены в 3 и 4 уравнениях реакций.
Итого: 2 балла.
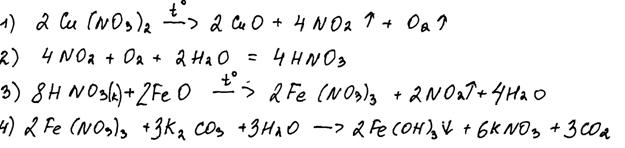
Комментарий
В уравнении реакции 3 есть удвоенные коэффициенты, но это не ошибка.
Итого: 4 балла.
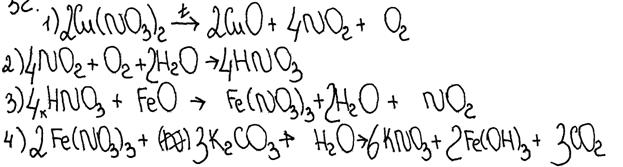
Комментарий
В уравнении реакции 4 пропущен коэффициент перед формулой воды.
Итого: 3 балла.
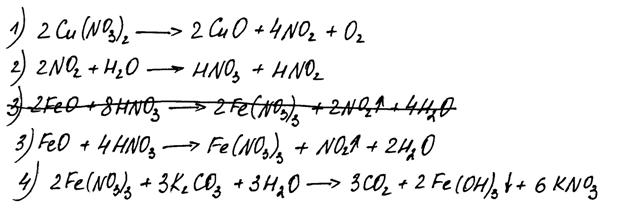
Комментарий
Уравнение реакции 2 не соответствует условию задания.
Итого: 3 балла.
Задание 32
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
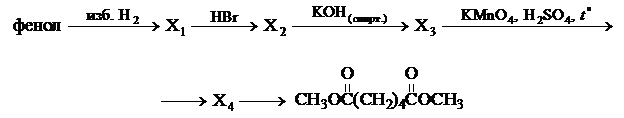
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.