| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Вариант ответа
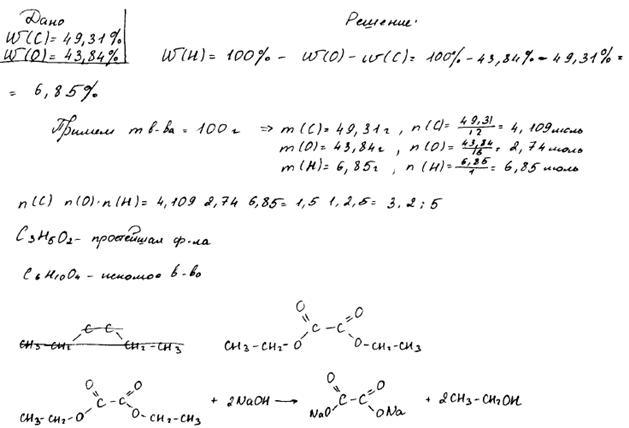
Проведены вычисления, и найдена молекулярная формула органического вещества.
Общая формула – CxHyOz
x: y: z = 49,31 / 12: 6,85 / 1: 43,84 / 16 = 4,11: 6,85: 2,74 = 3: 5: 2
Простейшая формула – C3H5O2
Молекулярная формула – C6H10O4
Составлена структурная формула вещества:
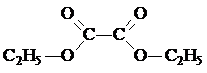 Написано уравнение реакции с гидроксидом натрия:
Написано уравнение реакции с гидроксидом натрия:

| |
| Ответ правильный и полный, содержит следующие элементы: · правильно произведены вычисления, необходимые для установления молекулярной формулы вещества, и записана молекулярная формула вещества; · записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; · с использованием структурной формулы органического вещества записано уравнение реакции, на которую даётся указание в условии задания | |
| Правильно записаны два элемента ответа | |
| Правильно записан один элемент ответа | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 3 |
Комментарий
Расчёты для определения молекулярной формулы – 1 балл; структурная формула – 1 балл; уравнение реакции – 1 балл.
Итого: 3 балла.

Комментарий
Расчёты для определения молекулярной формулы – 1 балл; структурная формула – 1 балл; уравнение реакции – 0 баллов.
Итого: 2 балла.



 Комментарий
Комментарий
Расчёты для определения молекулярной формулы – 1 балл; структурная формула – 0 баллов (не соответствует условию); уравнение реакции – 0 баллов.
Итого: 1 балл.

 Комментарий
Комментарий
Расчёты для определения молекулярной формулы – 1 балл; структурная формула – 0 баллов; уравнение реакции – 0 баллов.
Итого: 1 балл.
Приложение 1
Обобщённый план варианта КИМ ЕГЭ 2022 года
По ХИМИИ
Используются следующие условные обозначения.
Уровни сложности заданий: Б – базовый; П – повышенный; В – высокий.
| Номер задания | Проверяемые элементы содержания | Коды проверяемых элементов содержания по кодификатору | Коды требований | Уровень сложности задания | Макс. балл за выполнение задания | При-мерное время выполнения задания (мин.) |
| Часть 1 | ||||||
| Строение электронных оболочек атомов элементов первых четырёх периодов: s -, p- и d -элементы. Электронная конфигурация атома.Основное и возбуждённое состояния атомов | 1.1.1 | 1.2.1, 2.3.1 | Б | 2–3 | ||
| Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | 1.2.1, 1.2.2, 1.2.3, 1.2.4 | 1.2.3, 2.4.1, 2.3.1 | Б | 2–3 | ||
| Электроотрицательность. Степень окисления и валентность химических элементов | 1.3.2 | 1.1.1, 2.2.1 | Б | 2–3 | ||
| Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения | 1.3.1, 1.3.3 | 2.2.2, 2.4.2, 2.4.3 | Б | 2–3 | ||
| Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) | 2.1 | 1.3.1, 2.2.6 | Б | 2–3 | ||
| Характерные химические свойства простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена | 1.4.5, 1.4.6, 2.5, 2.6, 2.7 | 1.1.1, 1.1.2, 1.2.1, 2.3.3, 2.4.4 | П | 5–7 | ||
| Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). Характерные химические свойства неорганических веществ: – простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) | 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7 | 1.3.1, 2.2.6, 2.3.3 | П | 5–7 | ||
| Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная); Характерные химические свойства неорганических веществ: – простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) | 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7 | 1.3.1, 2.2.6, 2.3.3, 2.4.3, 2.4.4 | П | 5–7 | ||
| 9 | Взаимосвязь неорганических веществ | 2.8 | 2.3.3, 2.4.3 | Б | 2–3 | |
| Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) | 3.3 | 2.2.6 | Б | 2–3 | ||
| Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | 3.1, 3.2 | 1.2.1, 2.2.2, 2.2.3, 2.2.7 | Б | 2–3 | ||
| Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории). Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории) | 3.4, 3.5, 3.6, 4.1.7, 4.1.8 | 1.3.4, 2.3.4, 2.4.4, 2.5.1 | Б | 2–3 | ||
| Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки | 3.7, 3.8 | 2.3.4 | Б | 2–3 | ||
| Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Важнейшие способы получения углеводородов. Ионный (правило В.В. Марковникова) и радикальные механизмы реакций в органической химии | 3.4, 4.1.7 | 2.3.4, 2.4.4 | П | 5–7 | ||
| Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений | 3.5, 3.6, 4.1.8 | 2.3.4 | П | 5–7 | ||
| Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений | 3.9 | 2.3.4, 2.4.3 | Б | 2–3 | ||
| Классификация химических реакций в неорганической и органической химии | 1.4.1 | 2.2.8 | Б | 2–3 | ||
| Скорость реакции, её зависимость от различных факторов | 1.4.3 | 2.4.5 | Б | 2–3 | ||
| Реакции окислительно-восстановительные | 1.4.8 | 2.2.1, 2.2.5 | Б | 2–3 | ||
| Электролиз расплавов и растворов (солей, щелочей, кислот) | 1.4.9 | 1.1.3, 2.2.5 | Б | 2–3 | ||
| Гидролиз солей.Среда водных растворов: кислая, нейтральная, щелочная | 1.4.7 | 2.2.4 | Б | 2–3 | ||
| Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов | 1.4.4 | 2.4.5 | П | 5–7 | ||
| Обратимые и необратимые химические реакции. Химическое равновесие. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ | 1.4.4, 4.3.3 | 1.1.1, 2.5.2 | П | 5–7 | ||
| Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений | 4.1.4, 4.1.5 | 2.5.1 | П | 5–7 | ||
| Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений.Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | 4.1.1, 4.1.2, 4.2.1, 4.2.2, 4.2.3, 4.2.4, 4.2.5 | 1.3.2, 1.3.3, 1.3.4, 2.2.4 | Б | 2–3 | ||
| Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе» | 4.3.1 | 2.5.2 | Б | 3–4 | ||
| Расчёты теплового эффекта (по термохимическим уравнениям) | 4.3.4 | 2.5.2 | Б | 3–4 | ||
| Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси | 4.3.3, 4.3.8, 4.3.9 | 2.5.2 | Б | 3–4 | ||
| Часть 2 | ||||||
| Окислитель и восстановитель. Реакции окислительно-восстановительные | 2.8 | 2.3.3, 2.4.3, 2.4.4 | В | 10–15 | ||
| Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена | 1.4.8 | 2.2.5, 2.4.4 | В | 10–15 | ||
| Реакции, подтверждающие взаимосвязь различных классов неорганических веществ | 4.3.1 | 2.5.2 | В | 10–15 | ||
| Реакции, подтверждающие взаимосвязь органических соединений | 3.9 | 2.3.4, 2.4.3 | В | 10–15 | ||
| Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества. Расчёты массовой доли (массы) химического соединения в смеси | 4.3.1, 4.3.5, 4.3.6, 4.3.9 | 2.5.2 | В | 20–25 | ||
| Установление молекулярной и структурной формул вещества | 4.3.7 | 2.5.2 | В | 10–15 | ||
| Всего заданий – 34; из них по типу заданий: с кратким ответом – 28, с развёрнутым ответом – 6; по уровню сложности: Б – 20;П – 8;В – 6. Максимальный первичный балл за работу – 56. Общее время выполнения работы –210 мин. |
Указания по оцениванию развёрнутых ответов участников ЕГЭ для эксперта, проверяющего развёрнутые ответы на задания 29–34
по ХИМИИ в 2022 году
(документ предоставляется эксперту при проведении оценивания экзаменационных работ вместе с критериями оценивания)
При проверке выполнения заданий с развёрнутым ответом эксперт руководствуется стандартизированными материалами, в которых представлены: критерии и шкалы оценивания выполнения заданий, а также варианты развёрнутых ответов на каждое из заданий части 2 экзаменационной работы.
Проверка и оценивание выполнения заданий с развернутым ответом осуществляется на основе поэлементного анализа ответов экзаменуемых. Метод поэлементного анализа предполагает установление наличия в ответах экзаменуемых каждого из элементов ответа, обозначенного в критериях оценивания.
Ответ экзаменуемого по своему содержанию и последовательности изложения может отличаться от предложенного в критериях варианта ответа. При этом оценивание выполнения задания осуществляется также в соответствии с общими критериями оценивания.
Результаты оценивания переносятся в Протокол проверки развёрнутых ответов, при этом баллы по каждому заданию переносятся в колонку, название которой соответствует номеру задания (см. рисунок 1):
– баллы за задание 29 выставляются в колонку 29 протокола;
– баллы за задание 30 выставляются в колонку 30 протокола;
– баллы за задание 31 выставляются в колонку 31 протокола;
– баллы за задание 32 выставляются в колонку 32 протокола;
– баллы за задание 33 выставляются в колонку 33 протокола;
– баллы за задание 34 выставляются в колонку 34 протокола.
Внимание! При выставлении баллов за выполнение задания в «Протокол проверки ответов на задания бланка № 2» следует иметь в виду, что если ответ отсутствует (нет никаких записей, свидетельствующих о том, что экзаменуемый приступал к выполнению задания) (или указан только номер самого задания), то в протокол проставляется «Х», а не «0».

Рисунок 1. Протокол проверки развёрнутых ответов. Образец
Приложение 2
Извлечения из Методических рекомендаций Рособрнадзора по формированию и организации работы предметных комиссий субъекта Российской Федерации при проведении государственной итоговой аттестации
по образовательным программам среднего общего образования
Экспертам ПК запрещается:
· иметь при себе средства связи, фото-, аудио- и видеоаппаратуру;
· копировать и выносить из помещений, в которых работает ПК, экзаменационные работы, критерии оценивания, протоколы проверки экзаменационных работ;
· разглашать информацию, содержащуюся в указанных материалах.
Также запрещается:
· без уважительной причины покидать аудиторию;
· переговариваться с другими экспертами ПК, если речь не идёт о консультировании с председателем ПК или с экспертом ПК, назначенным по решению председателя ПК консультантом.
Если у эксперта возникают вопросы или проблемы, он должен обратиться к председателю ПК или лицу, назначенному председателем предметной комиссии консультантом.
Ниже приведены рекомендации по оцениванию отдельных элементов развёрнутых ответов и решению возникающих при этом возможных проблем.
| № зада-ния | Критерии детализации ответа по отдельным элементам | Рекомендации по оцениванию отдельных элементов ответа | Решение возможных проблемных ситуаций (дополнительные рекомендации, которые необходимо учитывать в проблемных ситуациях) |
| Правильный и полный ответ содержит следующие элементы: · выбраны вещества, и записано молекулярное уравнение окислительно-восстановительной реакции; · составлен электронный баланс, указаны окислитель и восстановитель | 1. Ставится 1 балл, если выбраны вещества из предложенного списка и составлено молекулярное уравнение окислительно-восстановительной реакции между ними, которое полностью соответствует условию задания: · выбраны вещества, вступающие в окислительно-восстановительную реакцию, признаки протекания которой соответствуют условию задания; · правильно составлены формулы веществ-продуктов этой окислительно-восстановительной реакции; · расставлены коэффициенты в уравнении реакции (при этом допустимо использование кратных коэффициентов, в том числе и дробных). 2. Ставится 1 балл за составление электронного баланса, если: · правильно указаны степени окисления элемента-окислителя и элемента-восстановителя, участвующих в процессах окисления и восстановления; · при составлении электронного баланса любым способом показано, что число отданных восстановителем электронов равно числу электронов, принимаемых окислителем; при этом может быть использован метод полуреакций (электронно-ионный баланс); · указаны окислитель и восстановитель | В качестве исходных веществ (окислителя и восстановителя) могут быть использованы только вещества из предложенного списка (вода используется в качестве среды для протекания реакций). Реакции диспропорционирования, которые протекают с участием среды (раствора щёлочи или кислоты), могут приниматься как верный ответ. Степень окисления 0 может не указываться экзаменуемым. Если степень окисления не указана, то считать её равной 0. Считать верными записи, подобные следующим: «Cl–1», «Cl–», «2Cr3+», «Cr+6», «Cl0», «Cl20», – которые может использовать экзаменуемый при указании степени окисления. Считать неверными записи, подобные следующим: «N23–», «Cr26+» (или «N2–3», «Cr2+6»). Наличие в ответе экзаменуемого взаимоисключающих суждений или обозначений следует рассматривать как факт несформированности умения применять данные знания (например, знаки «+» и «–» в записи электронного баланса не соответствуют природе окислителя или восстановителя). Экзаменуемый может: · в качестве окислителя и восстановителя указать элементы в соответствующей строчке электронного баланса или отдельно выписать формулы/названия веществ; · обозначить окислитель и восстановитель одной буквой («В» и «О»). Второй элемент ответа (составление электронного баланса) оценивается, если: · первый элемент ответа оценён 1 баллом; · первый элемент ответа оценён 0 баллов из-за незначительных ошибок, таких как пропуск 1–2 коэффициентов и пр. Если из списка выбраны вещества, между которыми невозможно протекание окислительно-восстановительной реакции, или неверно указаны продукты реакции, то за молекулярное уравнение ставится 0 баллов и электронный баланс не оценивается – 0 баллов. При оценивании выполнения задания принимается во внимание тот факт, что экзаменуемый может использоватьсвой алгоритмвыполнения задания (отличный от предложенного «варианта ответа»). Если в ответе к данному заданию приводятся уравнения нескольких реакций, то проверяется правильность записи только первого из них | |
| Правильный и полный ответ содержит следующие элементы: · выбраны вещества, и записано молекулярное уравнение реакции ионного обмена; · записаны полное и сокращённое ионные уравнения реакции | 1. Ставится 1 балл, если выбраны вещества из списка и составлено молекулярное уравнение реакции ионного обмена между ними: · из предложенного списка веществ выбраны вещества, между которыми реакция ионного обмена протекает так, как указано в условии задания; · расставлены коэффициенты в молекулярном уравнении реакции. 2. Ставится 1 балл, если записаны полное и сокращённое ионное уравнения: · правильно указаны заряды ионов в каждом из ионных уравнений реакции (например, «Na+» или «SO42–»); · в ионном уравнении реакции формулы слабых электролитов, практически нерастворимых веществ и газов записаны в молекулярном виде; · в сокращённом ионном уравнении коэффициенты должны быть указаны минимальными целыми числами | При составлении как молекулярного, так и ионного уравнения реакции экзаменуемый может не использовать обозначения осадка «↓» или газа «↑». В случае выбора веществ, между которыми РИО не протекает или не соответствует условию задания, молекулярное уравнение оценивается в 0 баллов. Второй элемент ответа (ионные уравнения реакций) оценивается, если: · первый элемент ответа оценён 1 баллом; · первый элемент ответа оценен 0 баллов из-за незначительных ошибок, таких как пропуск коэффициентов и пр. Допустимо обозначение заряда иона подобно «Na1+», «Cl1–». Считать ошибкой обозначение заряда иона подобно «Na+1», «Cl–1», «SO4–2». При оценивании выполнения задания принимается во внимание тот факт, что экзаменуемый может использовать свой алгоритм выполнения задания (отличный от предложенного «варианта ответа»). Если в ответе к данному заданию приводятся уравнения нескольких реакций, то проверяется только первое из них | |
| Правильный и полный ответ содержит правильно записанные уравнения четырёх химических реакций, о которых шла речь в условии задания | 1. Ставится 1 балл за каждый из четырёх элементов ответа, если: · правильно записаны формулы всех веществ, участвующих в реакции; · указаны все коэффициенты (при этом допустимо использование кратных коэффициентов, в том числе и дробных); · в уравнениях реакций записаны формулы тех веществ, которые соответствуют условию задания, или являются продуктами реакций, протекающих при заданных условиях | При составлении уравнения реакции экзаменуемый может: · не указывать условия её проведения (прокаливание, катализатор). Если в ответе всё же указаны условия проведения конкретной реакции, не соответствующие её протеканию с образованием записанных продуктов, то данный элемент ответа следует считать ошибочным по причине наличия взаимоисключающих суждений; · при составлении уравнения реакции экзаменуемый может не использовать обозначения осадка «↓» или газа «↑». При оценивании выполнения задания также принимается во внимание тот факт, что экзаменуемый может использовать свой алгоритм выполнения задания (отличный от предложенного «варианта ответа»). Если в отдельных элементах ответа к данному заданию приводятся уравнения нескольких реакций, то проверяется только первое из них | |
| Правильный и полный ответ содержит правильно записанные уравнения пяти химических реакций, которые соответствуют схеме превращений, приведённой в условии задания | 1. Ставится 1 балл за каждый из пяти элементов ответа, если: · правильно записаны формулы всех веществ, участвующих в реакции, при этом использованы структурные формулы разного вида (развёрнутая, сокращённая, скелетная), которые однозначно отражают порядок связи и взаимное расположение заместителей и функциональных групп в молекуле органического вещества; · указаны все коэффициенты (при этом допустимо использование кратных коэффициентов, в том числе и дробных); · в уравнениях реакций записаны формулы тех веществ, которые соответствуют условию задания, или являются продуктами реакций, протекающих при заданных условиях | При составлении уравнения химической реакции экзаменуемый может: · использовать молекулярные формулы простейших представителей гомологических рядов: CH4, C2H2, C6H6, C2H5OH, CH2O, C6H12O6 (в реакции брожения или полного окисления); · не использовать обозначения осадка «↓» или газа «↑»; · не указывать условия проведения реакции (прокаливание, катализатор), так как в условии задания это не предусмотрено. Если в ответе всё же указаны условия проведения конкретной реакции, не соответствующие её протеканию с образованием записанных продуктов, то данный элемент ответа следует считать ошибочным по причине наличия взаимоисключающих суждений. При оценивании выполнения задания также принимается во внимание тот факт, что экзаменуемый может использовать свой алгоритм выполнения задания (отличный от предложенного «варианта ответа»). Если в отдельных элементах ответа к данному заданию приводятся уравнения нескольких реакций, то проверяется только первое из них | |
| Правильный и полный ответ содержит следующие элементы: · правильно записаны уравнения всех реакций, соответствующих условию задания; · правильно произведены вычисления, в которых использованы необходимые физические величины, заданные в условии задания; · продемонстрирована и логически обоснована последовательность использования во взаимосвязи физических величин, на основании которых проводятся расчёты; · в соответствии с условием задания определена искомая физическая величина | 1.Ставится 1 балл за наличие в ответе правильно записанных уравнений всех реакций, соответствующих условию задания, при этом: · правильно записаны формулы всех веществ, участвующих в реакции; · указаны все коэффициенты (при этом допустимо использование кратных коэффициентов, в том числе и дробных). 2. Ставится 1 балл за наличие в ответе правильно произведённых вычислений, в которых используются необходимые физические величины из числа указанных в условии задания. Например, произведены вычисления количества вещества, которое в условии дано в виде водного раствора и/или объёма газа. 3. Ставится 1 балл, если в ответе экзаменуемого продемонстрирована и логически обоснована последовательность использования во взаимосвязи физических величин, на основании которых проводятся расчёты. Иными словами, отражены все необходимые этапы расчётов с указанием пропорциональной зависимостимежду количеством (массой, объёмом) реагирующих веществ. 4.Ставится 1 балл, если в ответе экзаменуемого в соответствии с условием задания определена искомая физическая величина: · выбран верный способ для нахождения искомой физической величины; · правильно определены «промежуточные» физические величины, необходимые для её нахождения | Если допущена ошибка хотя бы в одном из уравнений реакций, даже при условии, что она не влияет на ход дальнейших вычислений, то за этот элемент ответа выставляется 0 баллов. Вычисления молярной массы веществ можно не приводить. Если в соответствии с условием задания должно быть определено вещество, взятое в избытке, а в ответе экзаменуемого отсутствует указание на избыток этого вещества, но ход дальнейших вычислений правильный, то в этом случае элемент ответа считается верным. В случае наличия в ответе экзаменуемого ошибок в вычислениях (не более трёх), которые привели к неверному ответу, оценка за выполнение задания снижается только на 1 балл. Если в ответе экзаменуемого не указаны единицы измерения искомых физических величин (более четырёх), то оценка за выполнение задания снижается на 1 балл. При оценивании выполнения задания принимается во внимание тот факт, что экзаменуемый может использоватьсвой алгоритмрешения задачи (отличный от предложенного «варианта ответа») | |
| Правильный и полный ответ содержит следующие элементы: · правильно произведены вычисления, необходимые для установления молекулярной формулы вещества, и записана молекулярная формула вещества; · записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; · с использованием структурных формул органических веществ записано уравнение реакции, на которую даётся указание в условии задания | 1. Ставится 1 балл за установление молекулярной формулы вещества на основании приведённых необходимых правильных вычислений. Ответ должен содержать расчёты, подтверждающие соответствие приведённой молекулярной формулы условию задачи. 2. Ставится 1 балл при наличии записи структурной формулы вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле органического вещества в соответствии с условием задания. 3. Ставится 1 балл при наличии записи уравнения реакции, на которую даётся указание в условии задания: · правильно записаны формулы всех веществ, участвующих в реакции, при этом использованы структурные формулы разного вида (развёрнутая, сокращённая, скелетная), которые однозначно отражают порядок связи и взаимное расположение заместителей и функциональных групп в молекуле органического вещества; · указаны все коэффициенты (при этом допустимо использование кратных коэффициентов, в том числе и дробных); · в уравнении реакции записаны формулы тех веществ, которые соответствуют условию задания, или являются продуктами, преимущественно образующимися в реакциях, протекающих при заданных условиях | Найденная молекулярная формула должна соответствовать истинной молекулярной формуле вещества, указанного в условии. Если структурная формула органического вещества не записана как отдельный элемент ответа, а присутствует лишь в уравнении реакции (в последнем элементе ответа) и составлена правильно, то этот элемент ответа считается выполненным, и выставляется 1 балл за «структурную формулу». Допустимо использование молекулярных формул для простейших представителей гомологических рядов: CH4, C2H2, C6H6, C2H5OH, CH2O и т.д., а также C6H12O6 (в реакции брожения или полного окисления). Если в условии задания идёт речь о веществах природного происхождения, под таковыми понимаются биологически важные вещества, такие как жиры, аминокислоты (независимо от положения аминогруппы), пептиды, белки, углеводы (моно-, ди-, олиго- и полисахариды). При оценивании выполнения задания принимается во внимание тот факт, что экзаменуемый может использоватьсвой алгоритмрешения задачи (отличный от предложенного «варианта ответа») |