Ацетилен является родоначальником гомологического ряда алкинов,
или ацетиленовых углеводородов.
| Алкины — это непредельные углеводороды, молекулы которых содержат, помимо одинарных связей, одну тройную углерод-углеродную связь. Состав их отражает общая формула CnH2n-2 |
Ацетилен — это бесцветный газ без запаха, малорастворимый в воде.
Рассмотрим химические свойства ацетилена, которые лежат в основе его применения.
Ацетилен на воздухе горит коптящим пламенем из-за высокого содержания углерода в его молекуле, поэтому для сжигания ацетилена используют кислород:
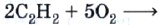
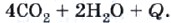
Температура ацетиленокислородного пламени достигает 3200 °С.
Таким пламенем можно резать и сваривать металлы (рис. 2).

Рис.2.
Ацетиленокислородное пламя используют для резки и сварки металла
Как и все непредельные соединения, ацетилен активно вступает в реакции присоединения.
1) галогенов (галогенирование),
2) водорода (гидрирование),
3) галогеноводородов (гидрогалогенирование),
4) воды (гидратация).
Рассмотрим, например, реакцию гидрохлорирования — присоединения хлороводорода:
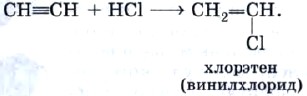
Почему продукт гидрохлорирования ацетилена называют хлорэтеном, вам понятно. А почему — винилхлоридом? Потому что одновалентный радикал этилена СН 2 =СН— называют винилом.
Винилхлорид — это исходное соединение для получения полимера — поливинилхлорида, который находит широкое применение (рис. 3). В настоящее время винилхлорид получают не гидрохлорированием ацетилена, а другими способами.
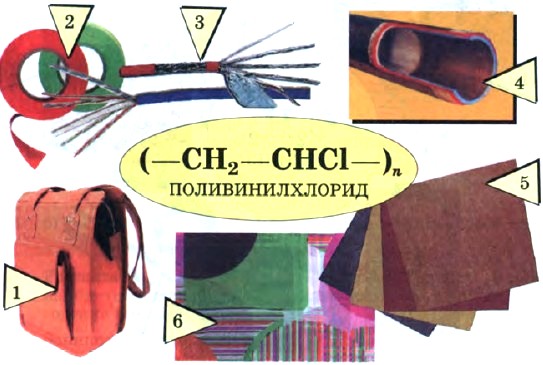
Рис. 3.
Применение поливинилхлорида:
1 — искусственная кожа; 2 — изолента; 3 — изоляция проводов; 4 — трубы; 5 — линолеум; 6 — клеенка
|
|
Поливинилхлорид получают с помощью уже знакомой вам реакции полимеризации. Полимеризация винилхло-рида в поливинилхлорид может быть описана с помощью следующей схемы:
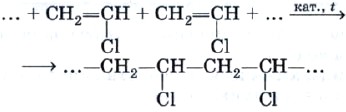
или уравнения реакции:
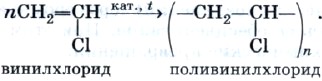
Реакция гидратации, протекающая в присутствии солей ртути, содержащих катион Hg2+, в качестве катализатора, носит имя выдающегося русского химика-органика М. Г. Кучерова и раньше широко использовалась для получения очень важного органического соединения — уксусного альдегида:
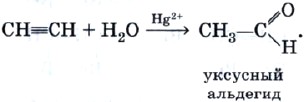
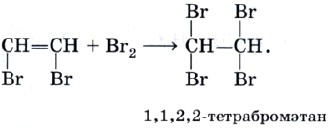
Реакцию присоединения брома — бромирование — используют как качественную реакцию на кратную (двойную или тройную) связь.
При пропускании ацетилена (или этилена, или большинства других непредельных органических соединений) через бромную воду можно наблюдать ее обесцвечивание. При этом происходят следующие химические превращения:
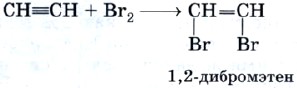
и далее:
Еще одной качественной реакцией на ацетилен и непредельные органические соединения является обесцвечивание раствора перманганата калия.
Ацетилен — важнейший продукт химической промышленности, который имеет широкое применение (рис. 4).

Рис. 4.
Применение ацетилена:
1 — резка и сварка металлов; 2—4 — производство органических соединений (растворителей 2, поливинилхлорида 3, клея 4)
Химические свойства, ацетилена: горение, присоединение галогеноводородов, воды (реакция Кучерова), галогенов.
Качественные реакции на кратную связь: обесцвечивание бромной
воды и раствора перманганата калия.
Домашнее задание. Ответе на вопросы:
· Назовите способы получения ацетилена. Запишите уравнения соответствующих реакций.
|
|
· Назовите две качественные реакции, с помощью которых можно обнаружить непредельный характер органического соединения.
· Рассчитайте массовую долю углерода в молекулах: а) этана; б) этилена; в) ацетилена. Каков характер пламени при горении этих веществ?
· Назовите область применения реакции горения ацетилена.
· Какие свойства ацетилена имеют отношение к строительным профессиям?
· Форма отчёта. Выполненные работы высылайте по адресу: svirkov2751@mail.ru