Существуют две основные гипотезы для объяснения того, как происходит синтез АТР в F1 за счет протонного градиента. В обеих гипотезах хемоосмотический принцип П. Митчелла принимается за основу механизма превращения энергии переноса электронов по дыхательной цепи в макроэргические связи АТР. П. Митчелл предлагает прямое участие протонов в реакции ADP с Pi в F1 с образованием АТР. П. Бойер, а также Е. Слейтер приводят аргументы в пользу непрямого конформационного сопряжения между Н+-помпой F0 и синтезом АТР.Согласно этой гипотезе, названной П. Бойером "Механизмом синтеза АТР путем связывания и обмена", синтез АТР из ADP и PI идет без затраты энергии, т.к.константа равновесия АТРазной - АТР-синтазной реакции в F1 близка к единице, а энергия градиента протонов необходима для диссоциации прочносвязанной синтезированной АТР от каталитической точки F1. Эта диссоциация вызывается, согласно гипотезе, конформационным изменением F1 за счет энергии протонного градиента. Накапливается все больше данных, подтверждающих конформационную гипотезу. Показано, что при одноточечном катализе на F1, АТР связывается с АТР-синтазой с константой связывания # 10 12/М, т. е. очень прочно. При переходе к двухточечному катализу, вызываемому, по-видимому, конформационным изменением F1 в результате протонирования, скорость диссоциации АТР возрастает в # 10 6 раз.
Вариантом хемиосмотической теории являются альтернативные гипотезы о роли "локализованного" протонного градиента взамен "делокализованного" по Митчеллу. Одним из основных аргументов противников"делокализованной" теории Митчелла являются экспериментально установленные факты, когда под влиянием ряда агентов (наркотики, жирные кислоты и др.) разобщение окислительного фосфорилирования происходит без заметного уменьшения, что не согласуется с основным постулатом Митчелла. Согласно гипотезе локального сопряжения, эти агенты рассеивают локальный протонный градиент без установления равновесия с окружающей водной фазой. Концепция делокализованного или локализованного протонного градиента, как источника механизма трансформации энергии, не получили до настоящего времени окончательного разрешения и находятся в стадии экспериментальных и теоретических проверок. Количество синтезированных молей АТФ на моль окисленного субстрата зависит от его вида (белка, жира, углевода) и от величины коэффициента фосфорилирования. Этот коэффициент, обозначаемый как Р/О, равен количеству синтезированных молекул АТФ в расчете на один атом кислорода, потребленный при окислении восстановленных органических соединений в процессе дыхания. При переносе каждой пары электронов по дыхательной цепи от НАД • Н до 02 величина Р/О = 2. Для субстратов, окисляемых НАД • Н2-зависимыми ферментами, Р/О = 1,3. Эти соотношения Р/О отражают энергетические затраты клетки на синтез АТФ в митохондриях и транспорт макроэрга против химического градиента из митохондрий к местам потребления.
6) Дыхательный контроль
Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз. Общее содержание АТФ в организме 30-50 г, но каждая молекула АТФ в клетке "живёт" меньше минуты. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Увеличение концентрации АДФ немедленно приводит к ускорению дыхания и фосфорилирования
7)
| Динитрофенолы |
| Динитрофенолы, группа пестицидов комплексного (гербицидного, фунгицидного и инсектицидного) действия. Наиболее активны препараты на основе 2,4-динитро-6-алкилфенолов, из которых наибольшее применение в сельском хозяйстве получили динитрофенол (ДНФ), динитроортокрезол (ДНОК), динитрофтор-бутилфенол (ДНБФ) и нитрофен. Нитропроизводные фенола обладают сравнительно малой летучестью, не гидролизуются при действии воды, могут восстанавливаться в нитро-, а затем аминосоединения. Более активны в кислой среде, с повышением рН активность уменьшается. Универсальность действия динитрофенолов объясняется способностью при попадании в организм разобщать процессы дыхательного фосфорилирования, вызывая гидролиз аденозинтрифосфорной кислоты (АТФ) в ходе реакций дыхательной цепи. В виноградарстве используется 1%-ный раствор ДНОК или 3%-ный нитрофен (по действующему веществу) из расчета 1000—3000 л/га для ранневесеннего искореняющего опрыскивания почвы против возбудителей милдью, антракноза, пятнистостей, а также промывки кустов с целью уничтожения зимующих вредителей (клещей, щитовок, пядениц и др.). Динитрофенолы для человека и теплокровных животных сильно ядовиты (как правило, запрещены в приусадебном виноградарстве). Работать с препаратом лучше в прохладное время суток, тщательно защищая кожные покровы и органы дыхания; продолжительность работы не должна превышать 4 ч. |
Жирные кислоты, находящиеся в комплексе с альбуминами, обозначаются термином неэстерифицированные жирные кислоты (НЭЖК). Неэстерифицированные жирные кислоты это свободные, (СЖК) не связанные жирные кислоты, в плазме крови эти длинноцепочечные СЖК образуют комплекс с альбумином, а в клетках связываются с так называемым Z-белком. Они откладываются в жировой ткани в виде триглицеридов (пальмитиновая, олеиновая и линолевая кислоты). Мобилизация триглицеридов в метоболизм определяется работой гормонзависимой липазы. Липолиз приводит к высвобождению в плазму жирных (нестерифицированных) кислот и глицерина, и липолиз усиливается при остром стрессе, длительном голодании и недостатке инсулина. В здоровом организме концентрация свободных жирных кислот колеблется в пределах от 0.4 до 0.8 ммоль/л.
Антибио́тики (от др.-греч. ἀντί — против + βίος — жизнь) — вещества природного или полусинтетического происхождения, подавляющие рост живых клеток, чаще всего прокариотических или простейших.
По ГОСТ 21507-81 (СТ СЭВ 1740-79)
Антибиотик — вещество микробного, животного или растительного происхождения, способное подавлять рост микроорганизмов или вызывать их гибель. Антибиотики природного происхождения чаще всего продуцируются актиномицетами, реже — немицелиальными бактериями. Некоторые антибиотики оказывают сильное подавляющее действие на рост и размножение бактерий и при этом относительно мало повреждают или вовсе не повреждают клетки макроорганизма, и поэтому применяются в качестве лекарственных средств. Некоторые антибиотики используются в качестве цитостатических (противоопухолевых) препаратов при лечении онкологических заболеваний. Антибиотики не воздействуют на вирусы, и поэтому бесполезны при лечении заболеваний, вызываемых вирусами (например, грипп, гепатиты А, В, С, ветряная оспа, герпес, краснуха, корь).
8) Механизм образования эл потенциала. Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены, скорость использования АТФ регулирует скорость потока электронов в цепи переносов электронов, АТФ не используется, поток электронов прекращается. Распад АТФ и образование из него АДФ увеличивает окисление субстратов и поглощение О2. Зависимость интенсивности дыхания митохондрий от концентрации АДФ = дыхательная концентрация. В рез-те его действия скорость синтеза АТФ соответствует потребностям клеток в энергии. Общее сод-ие АТФ в организме 30-50 гр, но каждая молекула АТФ живет меньше 1 мин. Коэфф. фосфорилирования. В расчете на каждый атом поглащенного кислорода или на пару переносимых электронов от НАД*Н2 к О2, митохондрии образуют 3 молекулы АТФ. Отношение кол-ва связанной Н3РО4 и кол-ву поглащенного О2 называют коэффициентом фосфолирирования или стехиометрическим коэф. Он равен меньше 3. Если первичной дегидрогеназой является ФАД, то в цепи переноса действуют только 2 пункта перекачки протонов и стех коэф меньше 2. А так как в среднем = 2,6 – 2,8. В митохондриях не всегда окисление сопряено с фосфолорированием, такой путь окисления сульфатом называется нефосфорилированным или свободным. Энергия идет на образование тепла.
Бурая жировая ткань, бурый жир (англ. Brown adipose tissue, BAT) — один из двух видов жировой ткани у млекопитающих. Хорошо развита у новорожденных и у животных, впадающих в спячку.[1] Основной функцией ткани является несократительный термогенез (часть механизма терморегуляции). В отличие от белых адипоцитов (клеток белой жировой ткани), имеющих одну крупную жировую каплю, в адипоцитах бурой ткани имеется несколько небольших жировых капель и множество митохондрий, содержащих железо (в цитохромах) и обуславливающих бурый цвет ткани.[2] Бурая жировая ткань также содержит больше капилляров, чем белая жировая ткань, так как у нее выше потребность в кислороде. Окислительная способность митохондрий бурого жира в 20 раз выше, чем у белого жира. При термогенезе в бурой ткани задействован белок термогенин, который разобщает окислительное фосфорилирование и дыхание.
Небольшое количество бурой жировой ткани имеется и у взрослых людей.[3] В клетках обнаруженной ткани было показано наличие мРНК, соответствующей термогенину.
9) Ци́кл трикарбо́новых кисло́т (цикл Кребса, цитратный цикл, цикл лимонной кислоты) — центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков, до CO2. При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая непосредственное участие в синтезе универсального источника энергии — АТФ.Цикл Кребса — это ключевой этап дыхания всех клеток, использующих кислород, центр пересечения множества метаболических путей в организме. Кроме значительной энергетической роли циклу отводится также и существенная пластическая функция, то есть это важный источник молекул-предшественников, из которых в ходе других биохимических превращений синтезируются такие важные для жизнедеятельности клетки соединения как аминокислоты, углеводы, жирные кислоты и др.Цикл Кребса регулируется «по механизму отрицательной обратной связи», при наличии большого количества субстратов (ацетил-КоА, оксалоацетат), цикл активно работает, а при избытке продуктов реакции (NADH, ATP) тормозится. Регуляция осуществляется и при помощи гормонов, основным источником ацетил-КоА является глюкоза, поэтому гормоны, способствующие аэробному распаду глюкозы, способствуют работе цикла Кребса. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса.Как правило работа цикла Кребса не прерывается за счёт анаплеротических реакций, которые пополняют цикл субстратами: Пируват + СО2 + АТФ = Оксалоацетат (субстрат Цикла Кребса) + АДФ + Фн.
10) Главная роль ЦТК — образование большого количества АТФ. Значения ЦТК:
1) главный источник АТФ. Энергию для образования большого количества АТФ дает полный распад Ацетил-КоА до СО2 и Н2О;
2) универсальный терминальный этап катаболизма веществ всех классов;
3) играет важную роль в процессах анаболизма (промежуточные продукты ЦТК): а) из цитрата ——>синтез жирных кислот; б) из a-кетоглутарата и ЩУК (щавеливо-уксусная кислота) ——> синтез аминокислот; в) из ЩУК ——> синтез углеводов; г) из Сукцинил-КоА ——> синтез гема гемоглобина.
Автономная саморегуляция ЦТК. В ЦТК два ключевых фермента: цитратсинтаза (1-я реакция) и изоцитратдегидрогеназа (3-я реакция).Оба фермента аллостерически ингибируются избытком АТФ и НАДН2. Изоцитратдегидрогеназа сильно активируется АДФ. Если АДФ нет, то этот фермент неактивен.
Челночные механизмы переноса водорода. Никотинамидные дегидрогеназы находятся не только в матриксе митохондрий, но и в цитозоле. Митохондриальная мембрана непроницаема для НАД, поэтому НАДН2, который образуется в цитозоле, может передать свой водород в митохондрию только с помощью специальных субстратных челночных механизмов. В митохондрию из цитозоля передается не сам НАДН2, а только водород, отнятый от него. Переносимый водород включается в молекулу вещества-челнока, способного проникать через митохондриальную мембрану. В митохондрии вещество-челнок отдает водород на митохондриальный НАД или ФАД и возвращается обратно в цитозоль. Два типа челночных механизмов: 1) малат-аспартатный (наиболее универсален для клеток организма). С высокой скоростью работает в миокарде, почечной ткани, печени. В этой транспортной системе водород от цитоплазматического НАД передается на митохондриальный НАД, поэтому в митохондриях образуется 3 молекулы АТФ и не происходит потери энергии при переносе водорода. Для ткани печени малат-аспартатная система особенно важна, так как из митохондрии выводится Ацетил-КоА (в виде цитрата), а водород попадает в митохондрию (в составе малата). Таким образом происходит не только челночный транспорт водорода от цитоплазматического НАД к митохондриальному, но и обратный транспорт Ацетил-КоА из митохондрий в цитоплазму в виде цитрата. В цитоплазме Ацетил-КоА может быть использован для синтеза жирных кислот; ЩУК может вернуться в цитоплазму и другим способом, вступив в реакцию трансаминирования с глутаминовой кислотой; 2) глицерофосфатный (встречается реже). Водород от цитоплазматического НАД передается на митохондриальный ФАД, и в митохондриях образуется 2 молекулы АТФ вместо 3 — происходит потеря энергии при переносе водорода. В клетке существует не только челночный транспорт водорода от цитоплазматического НАД к митохондриальному. Происходит и обратный транспорт Ацетил-КоА из митохондрий в цитоплазму в виде цитрата. В цитоплазме Ацетил-КоА может быть использован для синтеза жирных кислот. Тканевое дыхание. ЦТК связан с тканевым дыханием. Промежуточные метаболиты цикла являются субстратами окисления (изоцитрат, альфакетоглутарат, сукцинат и малат). В цикле происходит их окисление дегидрирование под действием НАД и ФАД зависимых дегидрогеназ. При этом НАД и ФАД восстанавливаются, то есть присоединяют водород:
изоцитрат + НАД → оксалосукцинат + НАДН2
(изолимонная кислота) (щавелевоянтарная кислота)
α-кетоглутарат + НАД → сукцинил-КоА + НАДН2
(α-кетоглутаровая кислота) (активная форма янтарной кислоты)
сукцинат + ФАД → фумарат + ФАДН2
(янтарная кислота) (фумаровая кислота)
малат + НАД → оксалоацетат + НАДН2
(яблочная кислота) (щавелевоуксусная кислота
Водород из цикла Кребса (в виде НАДН2 и ФАДН2) поступает в дыхательную цепь, где он используется как своего рода топливо. В дыхательной цепи происходит перенос протонов и электронов водорода на кислород с образованием воды. Выделяющаяся при этом энергия используется на образование АТФ.
11) Полное восстановление О2 в Н2О требует присоединения четырех электронов. В большинстве случаев в организме восстановление кислорода происходит поэтапно, с переносом одного электрона на каждом этапе. При присоединении первого электрона образуется супероксидный анион 2О-, который имеет на внешней орбитали неспаренный электрон. Такие атомы называются свободными радикалами. Супероксид, получая ещё одни электрон превращается в пероксид водорода Н2О2, присоединение третьего приводит к образованию молекулы воды и гидроксильного радикал ОН. Четвертый электрон превращает гидроксил в воду. Наряду с этим существует другой путь окисления – оксигеназный. Он не дает клетке энергии, кислород включается в субстрат с образованием новой гидроксильной или карбоксильной группы. Этот путь происходит в основном в мембранах эндоплазматического ретикулума (микросомах). Путем микросомного окисления осуществляется α- и ω- окисление жирных кислот, синтез ненасыщенных жирных кислот, стероидов. Таким путем обезвреживаются ксенобиотики, т. е. чужеродные для организма вещества (лекарства, ядохимикаты, косметические препараты). Ферменты, осуществляющие такое окисление, называются оксигеназами. Различают диоксигеназы, которые включают в молекулу субстрата два атома молекулы кислорода. Более распространены в клетках монооксигеназы (гидроксилазы). Они катализируют реакции, при которых в молекулу субстрата включается один атом из молекулы кислорода, второй же атом кислорода восстанавливается при этом до воды. Монооксигеназные системы представляют собой короткие цепи переноса электронов и протонов, источником которых служит чаще всего восстановленный НАДФ+, реже НАД+ или аскорбиновая кислота. Активатором кислорода при этом является цитохром Р450 – одноцепочечный хромопротеин с молекулярной массой 50 кДа. Молекулярный кислород при участии цитохромоксидазы восстанавливается до воды. Это основной путь его утилизации в клетке. В то же время небольшая часть кислорода (1-2%) претерпевает одноэлектронное восстановление до воды, в процессе которого образуются в качестве промежуточных продуктов высокореакционноспособные свободнорадикальные формы кислорода, способные оказывать токсическое действие Данный путь превращения показан на рис. 25-4. Восстановление молекулярного кислорода представлено серией присоединений по одному электрону таким образом, что каждый метаболит содержит на внешней орбитали неспаренный электрон. Вследствие этого свободнорадикальные метаболиты обладают высокой химической реакционной способностью, активно вступают в реакции, действуя в качестве окислителей. Они могут вызывать окисление биомакромолекул и инициировать цепные процессы, способные приводить к повреждению мембраны клетки. Токсичные метаболиты представлены на рис. 25-4: супероксидный анион-радикал кислорода (O2-), пероксид водорода (H2O2), гидроксильный радикал (ОН .). Токсичность кислорода определяется его реакционно-способными формами. Наиболее активной формой является синглетный кислород, *О2. Его высокая реакционоспособность приводит к неконтролируемым реакциям окисления, которые могут разрушить компоненты клетки, но могут приводить и к окислению устойчивых веществ, таких как лигнин. Для гашения действия синглетного кислорода организмы образуют антиоксиданты, например, каротиноиды с цепью чередующихся двойных связей. Поэтому организмы, развивающиеся на ярком свету, например, в высокогорных лишайниках, часто ярко окрашены. Токсическое действие света нередко обусловлено фотохимическим образованием токсичных форм кислорода, особенно радикала гидроксила. При дыхании происходит последовательное восстановление молекулы О2:
О2 + е" = О2* — супероксид,
образуется при окислении флавинами, флавопротеинами, хинонами, тиолами, железосерными белками; разлагается супероксидцисмутазой (СОД) по реакции:
2О2- + 2Н+ = Н2О2 + О2;
О2" + е" + 2Н+ = Н2О2 — перекись водорода, разлагается пероксидазами, например, по реакции
Н2О2 + НАДН2 = 2Н2О + НАДБИЛИ под действием каталазы разлагается с выделением О2 по реакции: 2Н2О2 = 2Н,0 + О2;
Н2О2 + е" = Н2О + ОН* — радикал гидроксила, неэнзиматический окислитель, восстанавливается до воды:
ОН* + е' + Н+ = Н2О
12) Резкое усиление окислительных процессов при недостаточности системы антиоксидантной защиты приводит к развитию оксидантного стресса, являющегося одним из универсальных механизмов повреждения тканей организма. Активность ферментативных антиоксидантных систем (каталазы, глутатион-пероксидазы) в мозге значительно ниже, чем в других тканях.
Свободный радикал представляет частицу молекулы с неспаренным электроном на одной из орбит. Кислородными радикалами (обладающими кислородом с неспаренным электроном) являются супероксид-анион и гидроксильный радикал.
В физиологических условиях кислородные радикалы вырабатываются во всех клетках как звено аэробного метаболизма. Полное восстановление молекулы кислорода до воды требует 4 электрона: во время переноса первого формируется супероксид-радикал, при переносе второго - перекись водорода, наиболее токсичный и реактивный гидроксил-радикал является результатом третьего переноса, а вследствие четвертого переноса образуется молекула воды. Акцепторами свободных радикалов в основном являются вещества с низкой молекулярной массой, расположенные в цитоплазме или на клеточных мембранах. В естественных условиях в качестве антиоксидантов действуют супероксиддисмутаза, глутатион, глутатион-пероксидаза, каталаза, церулоплазмин, витамин A, витамин Е, витамин С, витамин К, флавоноиды, кумарины. Вместе с тем в процессе неферментативного восстановления кислорода происходит образование активных и токсических интермедиатов – супероксидного радикала О2, перекиси водорода Н2О2 и наиболее реакционного гидроксильного радикала ОН. Считают, что если в процессе дыхания у человека 98% молекулярного кислорода полностью восстанавливается до воды, то оставшиеся 2% идут на образование потенциально токсичных молекул свободных радикалов с усиленной химической реактивностью из-за наличия неспаренного электрона на внешней орбите. Вследствие этого реакции неферментативного восстановления кислорода служат фоном, на котором осуществляются все процессы жизнедеятельности, и этот фон всегда является внутренней причиной возможности индуцирования мутаций.
Вместе с тем те самые системы, которые уже на заре возникновения жизни стали предохранять живую материю от внешних повреждений, а также ряд новых систем, возникших в процессе эволюции, защищают организм и от повреждений свободными радикалами прежде всего путем восстановления (репарации) ДНК и гашения различными способами свободнорадикальных реакций.
Значение различного типа повреждений, вызываемых свободными радикалами, нередко оценивается по эффективности применения антиоксидантов при тех или иных болезнях.
Этим способом была выявлена роль свободных радикалов в механизмах старения, канцерогенеза, некоторых аутоиммунных процессов, атеросклероза и ряда других патологических состояний.
13) сложный многостадийный цепной процесс окисления кислородом липидных субстратов, главным образом полиненасыщенных жирных кислот, включающий стадии взаимодействия липидов со свободнорадильными соединениями и образования свободных радикалов липидной природы. О. п. фосфолипидов биологических мембран играет важную роль в жизнедеятельности живых организмов. Усиление процессов О. п. имеет существенное значение в этиологии и патогенезе многих заболеваний и развитии последствий различных экстремальных воздействий.
Перекисное окисление является частным случаем жидкофазного окисления углеводородов. Оно представляет собой типичный цепной процесс с выраженным разветвлением. О. п. может включить стадии неферментативного аутоокисления и ферментативные реакции. Ферментативный и неферментативный пути О. п. приводят к образованию свободных радикалов липидов в несколько основных этапов: инициирование (зарождение цепи) 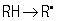 ,
,  , продолжение цепи
, продолжение цепи  ; разветвление цепи
; разветвление цепи  ; обрыв цепи
; обрыв цепи  молекулярные продукты,
молекулярные продукты, 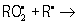 молекулярные продукты,
молекулярные продукты, 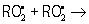 молекулярные продукты, где RH — субстрат окисления (полиненасыщенная жирная кислота). В инициировании О. п. решающую роль играют так называемые активные формы кислорода, в первую очередь кислородные радикалы, содержащие неспаренные электроны. В результате одноэлектронного восстановления молекулярного кислорода О2 в клетках образуется супероксидный анион-радикал
молекулярные продукты, где RH — субстрат окисления (полиненасыщенная жирная кислота). В инициировании О. п. решающую роль играют так называемые активные формы кислорода, в первую очередь кислородные радикалы, содержащие неспаренные электроны. В результате одноэлектронного восстановления молекулярного кислорода О2 в клетках образуется супероксидный анион-радикал 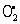 который возникает в электронпереносящей цепи митохондрий, хлоропластов, в реакциях, катализируемых некоторыми окислительными ферментами, при аутоокислении моноаминов и других соединений. При реакции дисмутации двух супероксидных радикалов образуется молекула перекиси водорода Н2О2; Другими источниками перекиси водорода являются реакции, катализируемые некоторыми оксидазами. В клетках существуют специальные системы обезвреживания токсичных кислородных радикалов, в частности ферментные: супероксиддисмутаза, катализирующая превращение супероксида в перекись водорода, каталаза и пероксидазы, катализирующие реакции, в которых перекись водорода восстанавливается до воды. К наиболее реакционноспособным и поэтому наиболее опасным радикалам кислорода относится гидроксильный радикал •ОН — один из основных повреждающих факторов при действии на живой организм ионизирующего излучения (Ионизирующие излучения). Значительная часть радикалов •ОН в живых организмах генерируется в результате реакций перекиси водорода и супероксидных радикалов с каталитическими количествами металлов переменной валентности, в первую очередь, с ионами железа и меди. Относительно малоактивные и долгоживущие
который возникает в электронпереносящей цепи митохондрий, хлоропластов, в реакциях, катализируемых некоторыми окислительными ферментами, при аутоокислении моноаминов и других соединений. При реакции дисмутации двух супероксидных радикалов образуется молекула перекиси водорода Н2О2; Другими источниками перекиси водорода являются реакции, катализируемые некоторыми оксидазами. В клетках существуют специальные системы обезвреживания токсичных кислородных радикалов, в частности ферментные: супероксиддисмутаза, катализирующая превращение супероксида в перекись водорода, каталаза и пероксидазы, катализирующие реакции, в которых перекись водорода восстанавливается до воды. К наиболее реакционноспособным и поэтому наиболее опасным радикалам кислорода относится гидроксильный радикал •ОН — один из основных повреждающих факторов при действии на живой организм ионизирующего излучения (Ионизирующие излучения). Значительная часть радикалов •ОН в живых организмах генерируется в результате реакций перекиси водорода и супероксидных радикалов с каталитическими количествами металлов переменной валентности, в первую очередь, с ионами железа и меди. Относительно малоактивные и долгоживущие  и Н2О2 могут служить источником взаимодействующего практически со всеми классами биомолекул радикала •ОН в присутствии микроколичеств свободных железа или меди. Наряду с радикалом •ОН непосредственными инициаторами О. п. могут быть и другие свободные радикалы, например протонированный супероксид-анион
и Н2О2 могут служить источником взаимодействующего практически со всеми классами биомолекул радикала •ОН в присутствии микроколичеств свободных железа или меди. Наряду с радикалом •ОН непосредственными инициаторами О. п. могут быть и другие свободные радикалы, например протонированный супероксид-анион  , а также синглетный кислород и ряд других активных форм кислорода.
, а также синглетный кислород и ряд других активных форм кислорода.
Продукты О. п., в частности перекиси липидов, используются в организме для синтеза биологически активных веществ — простагландинов (Простагландины), тромбоксанов, стероидных гормонов (Гормоны) и т.д. Интенсивность О. п. непосредственно связана с процессами обновления состава фосфолипидов биологических мембран, изменения относительного содержания липидов и белков и как следствие с изменением структуры биологических мембран и их функционирования. В живых организмах существует сложная система регуляции интенсивности процесса О. п. В норме процессы образования и расходования продуктов О. п. хорошо сбалансированы, что определяет их относительно низкое содержание в клетках. Скорость О. п. на уровнях инициирования, продолжения и обрыва цепи в значительной степени определяется структурной организацией липидов в биологической мембране. которая влияет на доступность остатков ненасыщенных жирных кислот (Жирные кислоты) для кислорода. Факторы, нарушающие «упаковку» липидов в биологической мембране, ускоряют, а факторы, поддерживающие структурированность липидов (например холестерин), тормозят О. п. Другим регуляторным компонентом системы О. п. являются ферменты, участвующие в образовании (например, некоторые оксидазы) или гибели (супероксиддисмутаза) активных форм кислорода и свободных радикалов, а также в разложении перекисей без образования свободных радикалов (каталаза, пероксидазы). Активность этих ферментов также может зависеть от структурированности липидного бислоя биологической мембраны. Практически на всех стадиях О. п. существенную модуляторную роль играют факторы, регулирующие обмен фосфолипидов биологических мембран и влияющие на скорость окисления путем изменения липидного состава мембран. Чрезвычайно важное значение в регуляции О. п. имеют многочисленные низкомолекулярные соединения, выполняющие функции инициаторов, катализаторов, ингибиторов, тушителей, синергистов этого процесса. К числу важнейших стабилизаторов биологических мембран относится природный антиоксидант (ингибитор О. п.) витамин Е; другими природными антиоксидантами являются гормоны тироксин и кортикостероиды, витамин К, глутатион. Свойствами прооксидантов (веществ, усиливающих О. п.) обладают ионы металлов переменной валентности, витамины С, D и др.
При развитии патологического процесса баланс образования и расходования перекисей и других продуктов О. п. может нарушаться, метаболиты О. п. накапливаются в тканях и биологических жидкостях, что приводит к серьезным нарушениям, в первую очередь, в биологических мембранах. Следствием активизации О. п. может быть изменение физико-химических свойств мембранных белков и липидов, изменение активности мембранно-связанных ферментов, нарушение проницаемости мембран (в т.ч. для протонов и ионов кальция), ионного транспорта (например, угнетение натриевого насоса), уменьшение электрической стабильности липидного бислоя мембран. Активация О. п. приводит к изменению структуры липопротеинов сыворотки крови и гиперхолестеринемии, нарушает разнообразные процессы клеточного метаболизма практически на всех уровнях.
Токсичными для организма являются не только образующиеся в результате О. п. перекиси, но и продукты более глубокого окисления липидов альдегиды, кетоны, кислоты. Карбонильные продукты О. п. ингибируют ряд ферментов, подавляют синтез ДНК, увеличивают проницаемость капилляров, модифицируют агрегацию тромбоцитов и проявляют ряд других нежелательных эффектов. Инициирующие О. п. и возникающие в процессе окисления реактивные свободные радикалы вызывают повреждение структуры нуклеиновых кислот (Нуклеиновые кислоты), прежде всего ДНК, деструкцию нуклеотидных коферментов (Коферменты), нарушения функционирования ферментов (в первую очередь SH-ферментов), ковалентную модификацию различных биомолекул. Следствием избыточной генерации свободных радикалов могут быть патологические изменения свойств сосудов.
Активация О. п. (так называемый синдром липидной пероксидации) является общим ключевым фактором, опосредующим повреждение мембранных структур органов и тканей при многих заболеваниях (за рубежом для таких заболеваний принят термин «свободнорадикальная патология»). Активация О. п. и роль в патогенезе показана при многих заболеваниях печени, артритах, атеросклерозе, ряде инфекций, вызываемых паразитами (например, малярии), заболеваниях легких, гипоксических, гипероксических и реперфузионных повреждениях органов и тканей, злокачественных опухолях, травмах, ожогах, катаракте и др. Для чрезмерной активации О. п., наблюдаемой в плазме (сыворотке) крови при идиопатическом гемохроматозе, в сыворотке крови и синовиальной жидкости при артритах и остеоартрите, в цереброспинальной жидкости при нейрональном липофусцинозе, основу создает избыток свободного железа и (или) меди в соответствующих органах. Возможная активация О. п. должна быть учтена при проведении лучевой терапии, ультрафиолетовом облучении, действии на организм различных полей (в т.ч. магнитного). При лечении в условиях гипербарической оксигенации возникающее в начале усиление О. п. за счет генерации активных форм кислорода исчезает после нескольких сеансов оксигенации. На разнообразных моделях стресса показано, что активация О. п. свидетельствует о срыве адаптивных механизмов и опосредует различные проявления повреждающего действия экстремальных факторов.
Активные формы кислорода (АФК, реактивные формы кислорода, РФК, англ. Reactive oxygen species, ROS) — включают ионы кислорода, свободные радикалы и перекиси как неорганического, так и органического происхождения. Это, как правило, небольшие молекулы с исключительной реактивностью благодаря наличию неспаренного электрона на внешнем электронном уровне. РФК постоянно образуются в живой клетке как продукты нормального метаболизма кислорода. Активные формы кислорода образуются также под действием ионизирующего излучения. Некоторые РФК могут играть роль медиаторов важных внутриклеточных сигнальных путей. Однако повышенная продукция РФК приводит к оксидативному стрессу. Нормальные функции РФК включают индукцию иммунной системы и мобилизацию систем ионного транспорта. Например, клетки крови на месте повреждения начинают продуцировать РФК, что рекрутирует тромбоциты, необходимые для начала процесса заживления раны. РФК также запускают программируемую клеточную смерть (апоптоз). Около 95 % от всего потребляемого кислорода клетки восстанавливается в митохондриях до воды в процессе окислительного фосфорилирования, при этом обязательной стадией является образование из молекулы кислорода двух гидроксильных OH-групп, также относящихся к РФК, при участии фермента цитохром с-оксидазы. Остальные 5 % кислорода в результате различных реакций (как правило ферментативных) превращаются непосредственно в РФК. Защита клетки от РФК осуществляется несколькими антиоксидантными ферментами (супероксиддисмутаза, каталаза и пероксиредоксины) и низкомолекулярными антиоксидантами (витамин С, глутатион, мочевая кислота). Кроме этого, антиоксидантными свойствами обладают полифенолы (например, аналоги некоторых компонентов красного вина). Инициация реакций свободнорадикальных и перекисных процессов активированными формами кислорода (АФК) и ионами металлов переменной валентности. Инициация свободнорадикального окисления возникает при ишемии, гипоксии, реоксигенации. Переокисление липидов, локализую-щеееся в мембранных структурах клеток, служит причиной инактивации ферментных систем поврежденных клеточных мембран и увеличения их проницаемости. Перекисное окисление липидов (ПОЛ) носит общебиологический характер и является необходимым метаболическим звеном. Оно протекает в здоровом организме и связано с процессом постоянного обновления липидного слоя клеточных мембран, с синтезом ряда гормонов, медиаторов, окислительным фосфорилированием, липолитической активностью и активностью ряда ферментов.
Контроль за активностью процессов ПОЛ осуществляет сложная многоуровневая антиокислительная система организма. Вследствие этого в нормальных условиях существует некое равновесное состояние между данной системой и интенсивностью свободнорадикальных реакций.
Перекисное окисление липидов мембран может осуществляться по ферментати вному и неферментативному механизму.
Ферментативное перекисное окисление липидов способствует модификации мембранных фосфолипидов, выполняет функции синтеза биологически активных веществ, детоксикации, метаболизма ксенобиотиков и эндогенных субстратов. Этот процесс локализован на ограниченных участках мембран и осуществляется НАДФ-зависимыми оксигеназами эндоплазматического ретикулума со смешанной функцией.
Неферментативное перекисное окисление липидов обладает выраженным разрушительным характером, что приводит к структурным нарушениям клеточных элементов и гибели самих клеток. Согласно общепринятым концепциям, высокая скорость неферментативного ПОЛ является основным универсальным механизмом повреждения и гибели клеток. При интенсивном образовании свободных радикалов и накоплении продуктов ПОЛ снижается активность ферментов антиокислительной системы организма (см. ссылку). Выраженная активация свободнорадикальных процессов, сопровождающаяся депрессией естественных антиоксидантных систем, определяет выраженность оксидантного стресса и скорость гибели клетки.
13) Каталаза (от греч. χαταλύω — разрушаю[ источник не указан 545 дней ]) — фермент (КФ 1.11.1.6), который разлагает образующуюся в процессе биологическо