Резюме: мы описываем в этой статье случай некролитической мигрирующей эритемы (НМЭ), наблюдаемый у собаки с циррозом печени, у которой оказалась успешна терапия октреотидом. Гистопатологическое исследование кожи выявило НМЭ. Показатели крови и результаты цитологии печени, УЗИ и компьютерная томография печени и поджелудочной железы показало тяжелый цирроз, однако в то время на поджелудочной железе не было обнаружено никакой массы или опухоли. В этом случае, можно считать, что заболевание кожи обусловлено хронической гепатопатией с вторичной гиперглюкагонемией. Были использованы октреатид, высокобелковая диета, жирные кислоты и добавки цинка, это обеспечивало временное клиническое улучшение. В конечном итоге наблюдались неврологические симптомы, связанные с печеночной недостаточностью, обильной рвотой, потерей веса и выраженной болезненностью и пациент был подвергнут эвтаназии. Посмертное исследование, в том числе вскрытие и микроскопическое исследование тканей подтвердило наш диагноз.
Некролитическая мигрирующая эритема - это заболевание кожи, характеризующееся некоторыми гистопатологическими данными, связанными с печенью или поджелудочной железой. Были сообщения о таких случаях у людей, собак, кошек и черных носорогах (3). Болезнь также известна как поверхностный некролитический дерматит (SND), гепатокожный синдром (HCS), метаболический эпидермальный некроз (MEN) и диабетическая дерматопатия (4,7). Однако некоторые авторы описывают поверхностный некролитический дерматит как прогрессирующее, изнуряющее кожное расстройство, которое обычно связанное с печеночными нарушениями. В 1986 году Вальтон и другие описали уникальный дерматоз у четырех собак с сахарным диабетом, которые имели клинические и гистологические черты НМЭ. Они считали, что до получения более подробной информации данный синдром следует отнести к диабетическому дерматозу (12). Т.к. заболевание у собак клинически, гистологически и причинно схоже с НМЭ у людей, мы предпочитаем использовать данный термин и для собак. Цель этого исследования - сообщить об успешности терапии октреатидом в случае НМЭ, возникшей по причине хронической гепатопатии (цирроза) у собаки.
Причина НМЭ до конца не объяснена, но есть несколько теорий о ее происхождении. Одной из них является повышение уровня глюкагона у некоторых пациентов. Наличие гиперглюкагонемии было признано у собак с сахарным диабетом и хронической недостаточностью печени. Согласно Торесс и Кейвуд (1997) НМЭ непосредственно связана с уровнем глюкагона в плазме крови. У пациентов с НМЭ, у которых удаляли опухоль, секретирующую глюкагон или вводили аналоги соматостатина или соматотропина, был замечен регресс кожных поражений (17). Также есть теория о влиянии гипоальбуминемии. Гипоальбуминемия возникает при хронических заболеваниях, таких как цирроз и синдром мальабсорбиции. Как известно, одной из физиологических ролей альбумина является транспортировка необходимых аминокислот и цинка (3). Цинк (кофактор) и незаменимые аминокислоты (особенно линолевая кислота) (предшественник) усиливают количество арахидоновой кислоты, которая играет важную роль на стадии пролиферации кожи (11). Другая теория заключается в том, что у пациентов с отсутствием глюкагонемии повышается уровень глюкагон-подобных гормонов, участвующих в патогенезе НМЭ. Эта теория поддерживает версию о том, энтероглюкагон или иные пептидные гормоны изменяют метаболизм аминокислот, имеющих эффект воздействия на процесс развития глюконеогенеза.
12,5-летняя стерилизованная сука, вест-хайленд-уайт-терьер была представлена в Государственный Университет штата Северная Каролина, Ветеринарный Учебный Госпиталь с жалобой на пододерматит, эритему и эрозию, прогрессирующие на поверхности кожи живота в течение года. В нашей клинике при дерматологическом обследовании обнаружили сухие, хрупкие, деформированные когти; был изменен окрас лап из-за чрезмерного облизывания и выкусывания. На подушечках лап были обнаружены трещины по краям, а межпальцевая область была влажной с наличием экссудации, эритем и корочек. Эритема, эрозия, трещины, корки и экссудат наблюдались также на вентральной части хвоста, в области промежности, около вульвы, перианальной области, в паху и на вентральной поверхности живота. Эти места были болезненны при пальпации. Гиперпигментация присутствовала в области паха, на вентральной части тела были также обнаружены эпидермальные воротнички. Отмечался выраженный зуд, в частности в промежности и в области лап. Цитология их межпальцевых пространств показала наличие бактерий и Malassezia spp.. Материал для биопсии брали из разных участков (с поверхности пальцев, бедер, вентральной части). Большинство образцов содержали диффузный паракератозный гиперкератоз, который распространялся также на воронку волосяного фолликула. В основном была обнаружена неравномерная эпидермальная гиперплазия с областями ламинарной гидропической дегенерации шиповатого слоя эпидермиса. В некоторых областях эпидермальное разъединение проходило через зону гидропических изменений и сливалось с эрозией или язвой. Шиповатый и базально-клеточные слои эпидермиса были диффузно гипербазофильны, с гиперпластическими клетками, характеризующимися наличием отчетливо видных ядрышек и увеличенными ядрами и цитоплазмой, имеющей более выраженную базофилию. Сочетание всех вышеизложенных изменений создало многоочаговые области эпидермиса с красным (паракератоз), белым (гидропическое изменение) и синим (гипербазофилия) узором, очень характерным для НМЭ.
Паракатозные корочка часто сливалась с нейтрофильными экссудатами, которые содержали множественные очаги скоплений кокковой группы бактерий. В поверхностной дерме были области умеренного отека и умеренные периваскулярные и интерстициальные инфильтраты, содержащие лимфоциты, плазматические клетки и некоторое количество нейтрофилов в областях эрозии и изъязвления (рис. 1).

Рисунок 1. Гистопатологический вид подушечек лап. Диффузный паракератозный гиперкератоз и ламинарная гидропическая дегенерация шиповатого слоя эпидермиса (H & E stain, x250).

Рисунок 2. Компьютерная томография. Поперечный срез брюшной полости. Печень меньшего размера и имеет множественные узелки.
По биохимическому профилю сыворотки крови повышалась глюкоза, щелочная фосфатаза, аланинаминотрансфераза и креатининкиназа (табл. 1). Инсулин в сыворотке составлял 1127 пмоль / л в качестве сывороточной глюкозы 8,1 пмоль / л. Соотношение инсулин / глюкоза составляло 139 (нормальный диапазон: 14-43). Был замечен незначительный рост билирубина в сыворотке (0,3 мг/дл).
Было проведено ультразвуковое исследование брюшной полости. Структура печени была неравномерной, также были выявлены гипоэехогенные узелки, как в левой, так и в правой доле печени, размером от 3,4 мм до 6,1 мм. Левая и правая доли были уменьшены и более отделены брыжейкой, чем обычно. Гипереэхогенные перегородки были идентифицированы с обеих сторон печени, как при фиброзе / циррозе. Эти изменения в большей степени соотносились с хроническим гепатитом или циррозом. Левая доля поджелудочной железы была ультрасонографически нормальной. Правая доля была гетерогенно гиперэхогенна, почти изоэхогенна по отношению к окружающей брыжейке, размером 9,9 мм. Тело поджелудочной железы не было идентифицировано. Изменения в правой доле поджелудочной железе соответствовали жировому инфильтрату и дегенеративным изменениям, как при фиброзе. Панкреатические массы или узелки не были обнаружены.
Примерно через 3 недели пациент был привезен в клинику для запланированного проведения компьютерной томографии (КТ). При КТ, поджелудочная железа была нормальной и образование, такое как глюкогонома не была идентифицирована. Печень была уменьшенной в размере с волнистыми и узловатыми краями. Полученные данные соответствовали циррозу и тяжелому хроническому заболеванию печени (рис. 2).
Была выполнена аспирация тканей печени под контролем УЗИ. Клеточность печени была низкой, отмечалась гемодилюция. Определялось умеренное количество скоплений гепатоцитов с округлым ядром, крупным хроматином, одним отчетливо видным синим округлым ядрышком и обильной розово-голубой цитоплазмой. Иногда эти гепатоциты имели большое ядерно-цитоплазматическое соотношение. На фоне препаратов отмечались умеренно дегенеративные нейтрофилы. Не было отмечено никаких доказательств наличия неоплазии.
Был проведен полный подсчет клеток крови. В то время как уровень эритроцитов и средней концентрации гемоглобина в отдельном эритроците (MCHC) были в пределах нормы, снижался уровень гемоглобина (13,5 г / дл); средний объем эритроцита (MCV) (55,4 FL); определили среднее содержание гемоглобина в отдельном эритроците (MCH) (17,7 пг). Было выполнено биохимическое исследование крови. Это подтвердило гипергликемию и повышение щелочной фосфотазы (ALP), гамма-глутамилтрансферазы (GGT) и ALT (Таблица 1).
Таблица 1: Биохимические параметры сыворотки крови на 1-й и 4-й неделе лечения.
| Тест | Результат 1 | Результат 2 | Ожидаемые | Единицы измерения |
| Glucose | 70-131 | Мг/дл | ||
| BUN | 6-26 | Мг/дл | ||
| TP | 5,4 | 5,7 | 5,2-7,3 | г/дл |
| Albumin | 3,4 | 3,3 | 3-3,9 | г/дл |
| ALP | 16-140 | МЕ/л | ||
| ALT | 12-54 | МЕ/л | ||
| GGT | 0-6 | МЕ/л |
BUN - мочевина, TP – общий белок, ALP – щелочная фосфотаза, ALT – аланинаминотрансфераза, GGT – гаммаглутаминтрансфераза.
Мы полагали, что причиной НМЭ у данного пациента является хроническое заболевание печени, что было установлено на основании результатов б/х исследования крови, КТ, УЗИ и биопсии печени. Было высказано предположение, что пациент имел НМЭ, ассоциированную с экстрапанкреатической глюкогономой и вторичной гиперинсулинемией. Это заключение было сформулировано в тот момент, когда мы оценивали следующий ряд данных: гистопатологическое заключение, повышение уровня инсулина в сыворотке крови, данные УЗИ, характерные для НМЭ. Уровень глюкагона в сыворотке крови на тот момент не мог быть определен нами.
Для купирования зуда и вторичной бактериальной и грибковой инфекции использовали цефподоксим (75 мг перорально, один раз в день), тербинафин (90 мг перорально, один раз в день) и Гексадин шампунь (ветеринарный), которые применяли до конца проведения всех диагностических тестов. После этого было начато лечение антагонистом глюкагона октреатидом (2 мг/кг 2 раза в день). Для стимуляции аппетита пациент получал миртазапин (0,5 мг/кг перорально 1 раз в день 14 дней). Корм Hills z/d поменяли на Hills n/d, также начали добавлять жирные кислоты и цинк. Местный лосьон с гидрокортизоном 1% и шампунь с хлоргексидином был рекомендован при вспышках кожных поражений. После последних препаратов и диеты аппетит увеличился, вернулась активность, кожные поражения регрессировали (Рис. 3).
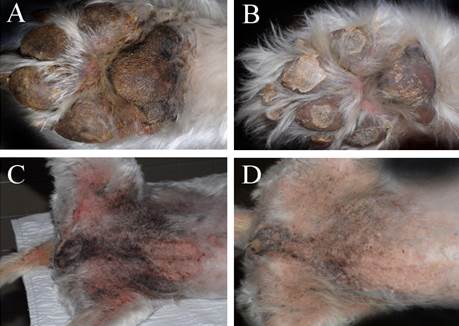
Рисунок 3. A) Внешний вид передней лапы с гиперкератозом, корочкой и межпальцевой эритемой перед применением октреатида. B) Внешний вид поражений после 14 дней лечения октреотидом. C) Отмечается гиперпигментация и эритематозный дерматит с наличием корочек на животе, в области вульвы и перианальных участков перед началом терапии октреотидом. D) Области поражений после 14 дней терапии октреотидом.
Однако, через 2 месяца произошла быстрая деградация его психического статуса (неврологические расстройства, такие как «взгляд в пустоту», связанные с гепатоэнцефалопатией), обильная рвота, потеря веса и выраженная болезненность. Это указывало на вероятную печеночную недостаточность, и собака была подвергнута эвтаназии. Первая проблема с кожей была отмечена 19 месяцев назад, до момента эвтаназии. Лечение октреотидом применяли на 15-м месяце заболевания. Наш пациент прожил примерно в течение 5 месяцев после начала лечения.
Провели вскрытие; установили: печень была диффузно хрупкая, рыхлая и наблюдалось многоочаговые поражения в виде светло-коричневых узелков (размером 0,1-2,0 см) (Рисунок 4).

Рисунок 4. Несколько узелков в печени, наблюдаемые при вскрытии.
Наблюдавшиеся тяжелые поражения кожи с наличием корочек и прогрессирующее заболевание печени согласовывались с сообщением о гепатокожном синдроме, представленным вариантом некролитической мигрирующей эритемы. Поджелудочная железа была вскрыта полностью, и глюкагоному не обнаружили. При проведении микроскопии края подушечки пальца эпидермис имел диффузную неравномерную гиперплазию с наличием участков паракератозного гиперкератоза (участки красного цвета), уменьшенную толщину (вплоть до полного отсутствия) зернистого слоя с наличием гидропических изменений (участки белого цвета), и более выраженной базофилией глубоких слоев эпидермиса (участки синего цвета). Поверхностная дерма содержала умеренный, периваскулярный инфильтрат, представленный лимфоцитами, эпизодически наблюдался экзоцитоз. В дополнение к ранее описанным изменениям наблюдались очаги с ортокератотическим гиперкератозом, лежащие в основе паракератозного изменения, с более выраженным зернистым слоем и менее выраженной базофилией, обнаруживаемых на подушечке пальца.
Синдром обычно наблюдается у собак в возрасте от 4 до 16 лет. НМЭ чаще встречается у таких пород, как вест-хайленд-уайт-терьер, джек расселл, йоркширский терьер, шелти и кокер-спаниель (3, 15). В этом исследовании пациент был 12,5-летним, породы вест-хайленд-уайт-терьер.
НМЭ у собак в основном ассоциируется с гепатопатией, новообразования, секретирующие глюкагон, редко встречаются (3). Большинство заболеваний печени являются идиопатическими. Однако было сообщено что эта проблема (НМЭ) возникала в связи с заболеванием, связанным с накоплением меди, поглощением микотоксина, длительным применением противосудорожных препаратов (таких как примидон) (3,8).
В данном случае посредством КТ и УЗИ новообразования обнаружены не были. Учитывая все результаты диагностических исследований, причиной НМЭ у нашего пациента было хроническое заболевание печени. От владельцев мы узнали, что пациент никаких препаратов длительным курсом не получал. Это побудило нас полагать, что хроническая болезнь печени может быть «идиопатической».
Гиперкератоз и трещины на лапах, экссудативно-язвенный дерматит, буллёзные и везикулярные поражения (3, 10), гиперпигментация чаще всего наблюдаются у собак при НМЭ (2). Повреждения наблюдаются на лапах; в кожно-слизистых областях и в местах, которые подвержены давлению и трению (3).
В этом случае были определены сходные очаги поражений и их локализаций.
Также было сообщение о паронихии (6). У этой собаки онихомаляция и ониходистрофия также были наблюдаемы. Летаргия, анорексия и потеря веса являются системными симптомами при НМЭ (3). В данном случае помимо них наблюдались также неврологические симптомы, обильная рвота и выраженная болезненность.
В исследовании, посвященном 35 собакам с MENHCS в Университете Пенсильвании, были определены повышенные желчные кислоты (100%), ALP (100%), ALT (86%) и сахарный диабет (43%), гипоальбуминемия (29%) (3). В нашем случае уровень глюкозы в сыворотке, ALP и ALT увеличивался. Анемия, по-видимому, является признаком гепатокожного синдрома у собак (1). В этом случае определяли микроцитарную нормохромную анемию. Ультрасонографический рисунок напоминает по виду дыры в сыре или пчелиные соты. (9). В нашем случае при УЗИ, паренхима печени была более гипоэхогенна, чем обычно. Но печень не имела типичного вида пчелиных сот.
Глюкагон не является гормоном, который обычно измеряется у собак (7). Секреция глюкагона может увеличиться втрое без значительного увеличения концентрации глюкагона в периферической плазме (14). В этом случае уровень глюкагона в плазме не измерялся. Однако УЗИ и КТ новообразований в поджелудочной железе не обнаружили. Как известно, у собак гиперглюкагонемия имеет место при сахарном диабете, панкреатите и хронической недостаточности печени (12). Мы диагностировали данный случай как хроническую гепатопатию (цирроз), связанную со вторичной гиперглюкагонемией.
Добавки жирных кислот можно использовать совместно с добавлением цинка (3). Наш пациент получал все эти компоненты. Некоторые авторы считают, что кортикостероиды противопоказаны пациентам NME (3). Тем не менее, в последние годы низкие дозы местного гидрокортизон начали успешно использовать у пациентов с НМЭ в медицине человека (5). На основании этой информации мы использовали слабый 1% лосьон с гидрокортизоном
Оберкирчнер с соавторами (2010) вводили октреотид в дозе 2 мкг / кг подкожно два раза в день собаке с глюкагономой. В течение 10 дней после начала лечения поражение кожи заметно улучшилось, и у пациента больше не проявлялись признаки хромоты или боли при ходьбе. Таким же образом и в нашем случае: после начала лечения октреотидом улучшалось общее состояние, отмечались улучшения кожных поражений, и прекратилась хромота у собаки. Эти улучшения отмечались через 14 дней после начала терапии этим препаратом
Мы полагаем, что качество жизни посредством применения октреотида и при наличии поддерживающей терапии может быть улучшено не только у пациентов с глюкагономой, но и при наличии хронической гепатопатии.
Литература:
1. Allenspach K, Arnold P, Glaus T, Hauser B, Wolff C, Eberle C, Komminoth P (2000): Glucagon-producing neuroendocrine tumour associated with hypoaminoacidemia and skin lesions. J Small Anim Pract, 41, 402-406.
2. Bond R, McNeil PE, Evans H, Srebernik N (1995): Metabolic epidermal necrosis in two dogs with different underlying diseases. Vet Rec, 136, 466-71.
3. Byrne KP (1999): Metabolic epidermal necrosishepatocutaneous syndrome. Vet Clin N Am-Small 29,
1337-55.
4. Godfrey DR, Rest JR (2000): Suspected necrolytic migratory ervthema associated with chronic hepatopathy in a cat. J Small Anim Pract, 41, 324-28.
5. Griffing GT (2013): Hyperglucagonemia treatment & management. Erişim tarihi: 18.06.2014. Erişim adresi: https://www.emedicine.medscape.com/article/121575-treatment.
6. Gross TL, O'Brien TD, Davies AP, Long RE (1990): Glucagon-producing pancreatic endocrine tumors in two dogs with superficial necrolytic dermatitis. J Am Vet Med Assoc, 197, 1619-22.
7. Gross TL, Song MD, Havel PJ, Ihrke PJ (1993): Superficial Necrolytic Dermatitis (Necrolytic MigratoryErythema) in Dogs. Vet Pathol, 30, 75-81.
8. Henricks PM (1987): Dermatitis associated with the useof primidone in a dog. J Am Vet Med Assoc, 191, 237-8.
9.Hill PB, Auxilia ST, Munro E, Genovese, L, SilkstoneMA, Kirby B (2000): Resolution of skin lesions and longtermsurvival in a dog with superficial necrolyticdermatitis and liver cirrhosis. J Small Anim Pract, 41,519-523.
10. March PA, Hillier A, Weisbrode SE, Mattoon JS,Johnson SE, DiBartola SP, Brofman PJ (2004):
Superficial Necrolytic Dermatitis in 11 Dogs with aHistory of Phenobarbital Administration (1995-2002). J Vet Intern Med, 18, 65-74.
11. Marsh KA, Ruedisueli FL, Coe SL, Watson TGD(2000): Effects of zinc and linoleic acid supplementation on the skin and coat quality of dogs receiving a complete and balanced diet. Vet Dermatol, 11, 277-284.
12. Miller WH, Scott DW, Buerger RG, Shanley KJ,Paradis M, McMurdy MA, Angarano DW (1990):
Necrolytic Migratory Erythema in Dogs: A Hepatocutaneousт Syndrome. J Am Anim Hosp Assoc, 26, 573-580.
13. Oberkirchner U, Linder KE, Zadrozny L, Olivry T(2010): Successful treatment of canine necrolytic
migratory erythema (superficial necrolytic dermatitis) due to metastatic glucagonoma with octreotide. Vet Dermatol,21, 510-516.
14. Outerbridge CA (2010): Hepatocutaneous Syndrome. 112. In: SJ Ettinger, EC Feldman. (Eds), Textbook ofVeterinary Internal medicine, 7th ed, Elsevier Saunders,St. Louis, Missiouri, USA.
15. Outerbridge CA, Marks SL, Rogers QR (2002): Plasma amino acid concentrations in 36 dogs with histologically confirmed superficial necrolytic dermatitis. Vet Dermatol,13, 177-186.
16. Torres S, Johnson K, McKeever P, Hardy R (1997):Superficial necrolytic dermatitis and a pancreatic
endocrine tumour in a dog. J Small Anim Pract, 38, 246-50.
17. Torres SMF, Caywood DD, O’Brien TD, O’Leary TP,McKeever PJ (1997): Resolution of Superficial NecrolyticDermatitis Following Excision of a Glucagon-Secreting Pancreatic Neoplasm in a Dog. J Am Anim Hosp Assoc, 33, 313-319.
18. Walton DK, Center SA, Scott DW, Collins K (1986): Ulcerative Dermatosis Associated with Diabetes Mellitus in the Dog: A Report of Four Cases. J Am Anim Hosp Assoc, 22, 79-88.