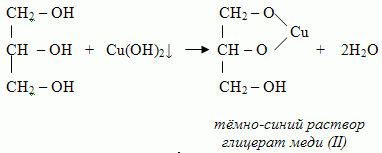Лекция 9. Спирты.
План.
1. Классификация спиртов. Гомологический ряд предельных одноатомных спиртов.
2. Номенклатура и изомерия предельных одноатомных спиртов.
3. Физические свойства. Физиологическое действие.
4. Состав и строение молекулы этанола.
5. Химические свойства.
6. Получение и применение.
7. Многоатомные спирты. Особенности строения, номенклатура, изомерия.
8. Строение, физические и химические свойства глицерина.
9. Получение, применение глицерина и его роль в живых организмах.
1. Соединения алифатического ряда, содержащие одну или несколько гидроксогрупп, называются спиртами
Если молекула содержит одну гидроксогруппу, то спирт называется одноатомным, если две – двухатомным, три – трехатомным и т.д. Для одноатомных спиртов общая формула: R-OH, где R- углеводородный алифатический радикал. Он может быть предельным, непредельным и даже содержать ароматическое кольцо. Тогда спирты так и называют: предельные, непредельные или ароматические.
Если группа –ОН посредственно соединена с бензольным кольцом, то производные будут называться фенолами.
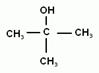
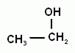
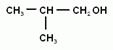
Кроме того, различают первичные, вторичные и третичные спирты, в зависимости от того с каким атомом углерода соединена группа –ОН.
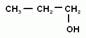
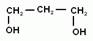
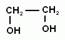
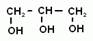
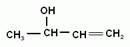
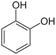
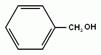
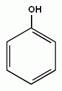
Мы начнем изучение спиртов с группы предельных одноатомных спиртов, т.е. радикал является остатком предельного углеводорода, и в молекуле спирта только одна гидроксогруппа.
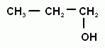
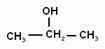
2. Номенклатура и изомерия предельных одноатомных спиртов.
Наличие гидроксогруппы (если она главная) обозначается в названии вещества суффиксом –ол. Положение гидроксогруппы в молекуле спирта указывается цифрой после суффикса. Нумерацию цепи начинают с того конца, ближе к которому находится гидроксильная группа.
Для спиртов возможна структурная изомерия и изомерия положения функциональной группы. Возможна и межклассовая изомерия с простыми эфирами. Число структурных изомеров быстро возрастает с увеличением числа углеродов. Для С4 сущестует четыре изомерных спирта, для С5 их восемь, а для С10 уже 567.
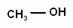
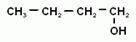
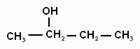
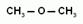
3. Физические свойства. Среди спиртов нет газов. Вследствие образования водородных связей между гидроксогруппами спиртов, они имеют аномально высокие температуры кипения. 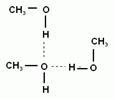
Например, этиловый спирт - это жидкость с характерным запахом и жгучим вкусом, перегоняется при 78,15о (такой спирт содержит 95,5% спирта (по массе) и называется ректификатом). Безводный этиловый спирт можно получить, связывая воду химически. Обычно концентрацию спирта выражают не в массовых долях (процентах), а в объемных. Объемные проценты называют градусами. При смешивании спирта и воды общий объем уменьшается, и эти величины не совпадают. Например, спирт-ректификат имеет крепость 96о. Т.о. при н.у. низшие спирты являются жидкостями, бесцветными и прозрачными, с характерным запахом. Спирты, содержащие более 15 атомов углерода являются твердыми веществами и запаха не имеют. Спирты могут растворяться в воде. (Почему?) Первые три члена гомологического ряда (метанол, этанол, пропанол) неограниченно растворимы в воде. С увеличением углеводородного радикала растворимость спиртов падает. Высшие спирты не растворимы в воде. Сами спирты являются хорошими растворителями для органических и для неорганических веществ.
Физиологическое действие спиртов. В растворах спиртов денатурирует белок. Метанол ( метиловый или древесный спирт) СН3ОН – сильный яд, в пищеварительном тракте образует формальдегид и муравьиную кислоту. Попадание в организм даже небольших (5-10 г) количеств метанола вызывает слепоту, а дозы от 30 г приводят к смертельному исходу. Этанол (виноградный или медицинский спирт) С2H5OH обладает наркотическим (затормаживаются реакции, нарушается координация, появляется эффект привыкания) и обезболивающим действием. При систематическом потреблении вызывает глубокие нарушения работы ЖКТ, печени, сердечно- сосудистой системы, разрушение нервной системы. В больших количествах и одноразовый прием - смертельно опасен (около 6—8 г/кг массы тела).
4. Строение молекулы этанола.
С2H5/→O ←H или С2H5→O ←/H
С появлением гидроксогруппы в молекуле спирта появляются две сильно полярные связи. Причем электронная плотность в обоих связях смещена к более электроотрицательному кислороду и на нем находится избыток электронной плотности. А на атоме водорода образуется частичный положительный заряд. Полярные связи рвутся легче, чем неполярные. Здесь у нас есть два варианта. Или образуется нуклеофильная группа гидроксогруппа ОН- и электрофил -С2H5. Или образуется нуклеофильная группа -OС2H5 и электрофил Н+.
5. Химические свойства.
1). Для спиртов возможна реакция замещения водорода на натрий (SЕ):
С2H5OH + Na  С2H5ONa + H2
С2H5ONa + H2
В этой реакции проявляются кислотные свойства спиртов, образующиеся вещества называют алкоголятами (этилат натрия). Но спирты нельзя назвать кислотами, потому что растворы спиртов имеют нейтральную реакцию, и со щелочами они не взаимодействуют.
2). Для спиртов более характерны реакции замещения гидроксогруппы (SN), например, с галогеноводородами:
С2H5 OH + H Cl → С2H5Cl + H-OH
3). Кроме того для спиртов возможны реакции отщепления (элиминирования Е).
СН3-СН2ОН → СН2=СН2 + H2O (реакция идет при нагревании выше 140 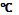 в присутствии конц. серной кислоты, как водоотнимающего средства). Внутримолекулярная дегидратация у гомологов этанола проходит по правилу Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
в присутствии конц. серной кислоты, как водоотнимающего средства). Внутримолекулярная дегидратация у гомологов этанола проходит по правилу Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
Реакция дегидратации и дегидрирования предельных одноатомных спиртов – реакция С.В. Лебедева
2C2H5OH 425,ZnO,Al2O3 → CH2=CH-CH=CH2 + H2 + 2H2O
Бутадиен-1,3
4). Межмолекулярная дегидратация (образование простых эфиров)
С2H5 OH + С2H5O H ↔ С2H5-O-С2H5+ H2O (реакция идет при нагревании до 140 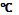 )
)
5) Реакции этерификации Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
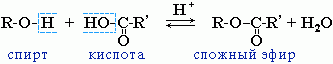
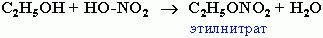
6). Как и все органические вещества спирты легко окисляются при повышенной температуре в присутствии воздуха.
С2H5OH + О2 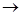 СO2 + H2O, причем ∆Н=1374 кДж. Спирт этанол горит бесцветным голубоватым пламенем.
СO2 + H2O, причем ∆Н=1374 кДж. Спирт этанол горит бесцветным голубоватым пламенем.
7). При действии более мягких окислителей из спирта образуются альдегиды (из первичного) или кетоны (из вторичного). Например:
Качественная реакция на первичные спирты!
СH3-CH2-OH + CuO 300°,Cu → CH3-C=O + Cu + H2O
│
H
(ацетальдегид – запах листвы)
Третичный спирт окисляется только при жестких условиях с разрывом связи С-С и образованием кислот и кетонов:
Получение и применение одноатомных спиртов
I. В промышленности
1. Из водяного газа (получение метанола – древесный спирт)
CO + 2H2 t,p → CH3OH
2. Брожение глюкозы (получение этанола)
C6H12O6 дрожжи → 2C2H5OH + 2CO2
3. Гидратация алкенов
СH3-CH=CH2 + HOH t,kat-H3PO4 → CH3-CH-CH3 (пропанол-2)
│
OH
присоединение по правилу Марковникова
II.В лаборатории
Взаимодействие галогеналкановR-Г с водными растворами щелочей
CH3Cl + NaOH t, водн.р-р.→ CH3OH + NaCl (р. обмена)
Метанол подвижная жидкость, запах очень похож на запах этанола, легко воспламеняется.Широко используется как растворитель. В органическом синтезе используют для получения формальдегида, а из него - полимеров. Может использоваться как добавка к бензину.
Этанол – в технике, парфюмерии, в пищевой и медицинской промышленности используется как очень хороший растворитель. Этиловый спирт – важное сырье для органического синтеза (каучук, сложные эфиры, синтетические волокна…). Кроме того, спирт в медицине используется как обезболивающее (общая нечувствительность) и дезинфицирующее средство (денатурирует белок). К спирту, который используется для технически целей, добавляют различные красители, другие спирты, формалин. Такой спирт называют денатурированным. Денатурат очень ядовит.
Многоатомными называют спирты, имеющие несколько групп –ОН. Различают гомологические ряды двухатомных спиртов, трехатомных и т.д. В названии многоатомных спиртов используют множительную приставку в суффиксе: ди-, три-, тетра- и т.д., Например:
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
СН2ОН—СН2ОН – этандиол или этиленгликоль
СН2ОН—СН2 —СН2ОН – пропандиол-1,3
СН2ОН—СНОН—СН3 - пропандиол-1,2 и т.д.
Обратите внимание: группы ОН- всегда находятся у разных атомов углерода. 
8. Наиболее важным из многоатомных спиртов является простейший трехатомный спирт - пропантриол -1,2,3, называемый просто глицерином:
СН2ОН—СНОН—СН2ОН.
Физические свойства.
Этиленгликоль - сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах, хорошо смешивается с водой, сильно понижает температуру замерзания воды (60%-ый раствор замерзает при -49 ˚С) –это используется в системах охлаждения двигателей – антифризы. Этиленгликоль токсичен – сильный Яд! Угнетает ЦНС и поражает почки.
Глицерин — сиропообразная бесцветная жидкость сладкого вкуса; температура замерзания 17°, кипения 290°С; плотность его 1,26.Глицерин неограниченно смешивается с водой и спиртом, но нерастворим в эфире и хлороформе; сам способен растворять многие органические (сахар), а также и неорганические соединения (многие соли, например гипс). При смешивании с водой происходит уменьшение объёма (контракция), достигающее наибольшего значения для смеси, содержащей 57% глицерина; при этом выделяется тепло. Чистый глицерин гигроскопичен, он поглощает до 40% воды (по весу). Водные растворы глицерина замерзают при низких температурах, например, смесь, содержащая 66, 7% глицерина, замерзает при минус 46,5°С.
1). Для глицерина характерны реакции нуклеофильного замещения спиртовых функциональных групп. Например, при взаимодействии глицерина с хлороводородом:
СН2 ОН -СН ОН -СН2 ОН + 3H Cl => СН2Cl-СНCl-СН2Cl + 3H2О
1,2,3-трихлорпропан
2) Реакции этерификации с азотной кислотой:
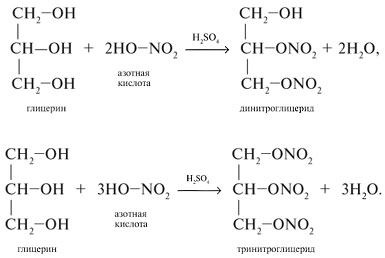
2). При действии на глицерин не только активных металлов (натрий), но даже оксидов и гидроксидов тяжелых металлов могут получаться производные глицерина — глицераты металлов, например меди. Это свидетельствует о том, что кислотные свойства у глицерина выражены значительно сильнее, чем у одноатомных спиртов.
СН2ОН—СНОН—СН2ОН + Na => СН2ОН—СНОН—СН2О-Na + H2
С гидроксидом меди(II) – качественная реакция!