Получение
1. Этиленгликоль (этандиол-1,2) синтезируют из этилена различными способами:
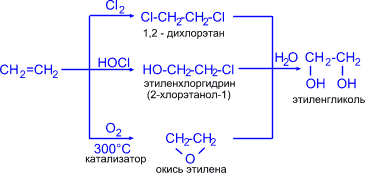
3CH2=CH2 + 2KMnO4 + 4H2O ® 3HO–CH2–CH2–OH + 2MnO2 + 2KOH
2. Глицерин (пропантриол -1,2,3) получают гидролизом жиров (см. "Жиры") или из пропилена по схемам:
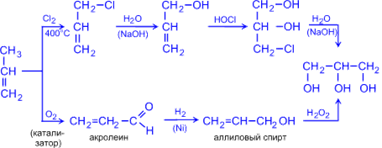
Физические свойства
Этиленгликоль и глицерин – бесцветные, вязкие жидкости, хорошо растворимые в воде, имеют высокие температуры кипения.
Химические свойства
Для многоатомных спиртов характерны основные реакции одноатомных спиртов. В отличие от них, они могут образовывать производные по одной или по нескольким гидроксильным группам, в зависимости от условий проведения реакций.
Многоатомные спирты, как и одноатомные, проявляют свойства кислот при взаимодействии с активными металлами, при этом происходит последовательное замещение атомов водорода в гидроксильных группах.
| CH2–OH I CH2–OH | Na –––® -1/2H2 | CH2–ONa I CH2–OH | Na –––® -1/2H2 | CH2–ONa I CH2–ONa |
Увеличение числа гидроксильных групп в молекуле приводит к усилению кислотных свойств многоатомных спиртов по сравнению с одноатомными.
Так, они способны растворять свежеосаждённый гидроксид меди (II) с образованием внутрикомплексных соединений:
| CH2–OH 2 I + Cu(OH)2(голубой осадок) ® CH2–OH | 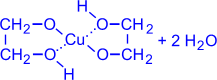 (гликолят меди (ярко-синий раствор))
(гликолят меди (ярко-синий раствор))
|
(одноатомные спирты с Cu(OH)2 не реагируют).
Глицерин легко нитруется, давая тринитроглицерин – сильное взрывчатое вещество (основа динамита):
| CH2–O- | -H | HO- | -NO2 | CH2–O–NO2 | |||
| I | H2SO4 | I | |||||
| CH –O- | -H | + | HO- | -NO2 | –––® | CH–O–NO2 | + 3H2O |
| I | I | ||||||
| CH2–O- | -H | HO- | -NO2 | CH2–O–NO2 |
При его взрыве выделяется большое количество газов и тепла:
| CH2–O–NO2 I 4CH–O–NO2 ® 12CO2 + 6N2 + 10H2O + O2 + Q I CH2–O–NO2 |
Применение
Этиленгликоль применяют:
1) в качестве антифриза;
2) для синтеза высокомолекулярных соединений (например, лавсана).
Глицерин применяют:
1) в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу);
2) в кожевенном производстве и в текстильной промышленности;
3) для производства нитроглицерина.
Фенолы. Получение. Физические и химические свойства
Фенолы содержат гидроксил непосредственно связанный с атомом углерода ароматического кольца. По числу гидроксильных групп, присоединенных к кольцу, фенолы подразделяются на одно-, двух- и многоатомные.
Изомерия фенолов обусловлена взаимным положением заместителей в бензольном кольце.
орто-крезол 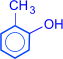 мета-крезол
мета-крезол 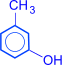 пара-крезол
пара-крезол 
Получение
Фенол в промышленности получают:
1) окислением изопропилбензола (кумола) в гидроперекись с последующим разложением её серной кислотой.
| CH3 I | CH3 I | ||||||
| H3C–CH | H3C–C–O–OH | OH | O | ||||
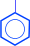
| O2 | 
| H2SO4 | 
| II | ||
| ® | –––® | + H3C– | C | –CH3 |
2) из бензола по способу Рашига:

| HCl + O2 | 
| H2O(Cu2+) | 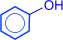
|
| ––––––® | ––––––® | |||
| -H2O | -HCl |
Химические свойства
1. Кислотные свойства у фенолов выражены сильнее, чем у спиртов. В результате сопряжения неподелённой пары электронов кислородного атома с p- электронной системой ароматического кольца, электронная плотность О-атома перемещается частично на связь С–О, увеличивая при этом электронную плотность в бензольном ядре (в особенности в орто- и пара-положениях). Электронная пара связи О–Н сильнее притягивается к атому кислорода, способствуя тем самым созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде протона.
| Hd+ ® | 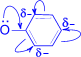
|
Фенолы, в отличие от спиртов, образуют феноляты не только при взаимодействии с активными металлами, но и с водными растворами щелочей.
| 2 | 
| OH + 2Na ® | 2 | 
| ONa(фенолят натрия) + H2 |

| OH + NaOH « | 
| ONa + H2O |
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией, идентифицирующей фенолы:
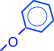
| ||||||
| 3 | 
| OH + FeCl3 « | 
| O–Fe | + 3 HCl | |
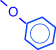
|
Фенолы – очень слабые кислоты, поэтому феноляты легко гидролизуются и разрушаются не только сильными, но и очень слабыми кислотами:

| ONa + H2SO4 ® | 
| OH + NaHSO4 |

| ONa + CO2 + H2O ® | 
| OH + NaHCO3 |
Фенолы образуют простые эфиры (синтез Вильямсона) и сложные эфиры

| O | Na + Br- | -CH2–CH3 ® | 
| O–CH2–CH3(этилфениловый эфир) + NaBr |
и сложные эфиры
| O II | O II | |||||

| O | H + Cl- | -C–CH3(хлорангидрид укс.кислоты) ® | 
| O– | C–CH3(фениловый эфир укс.кислоты) + HCl |
2. Реакции бензольного кольца. Гидроксильная группа у фенолов является очень сильным орто- и пара-ориентантом. Реакции замещения атомов водорода в бензольном кольце протекают в более мягких условиях, чем у бензола. При бромировании и нитровании могут быть получены 2,4,6-тризамещенные производные
| OH | OH | OH | ||||
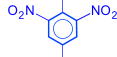
| + 3H2O | 3HNO3 ––– H2SO4 | 
| 3Br2 –––® | 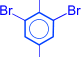
| + 3HBr |
| NO2 | Br | |||||
| 2,4,6 – тринитро- фенол (пикриновая кислота) | 2,4,6–трибром- фенол |
3. Гидрирование.
| OH | OH | |

| 3H2 ––® Ni |  (циклогексанол) (циклогексанол)
|
Применение
Фенол применяется при производстве фенолформальдегидных смол, в фармацевтической промышленности и как антисептик (карболовая кислота).
Гидрохинон (1,4-диоксибензол) – проявитель в фотографии.
Вопросы для самоконтроля по теме «Спирты и фенолы»
1. Особенности физических свойств спиртов:
- почему спирты, в отличие от углеводородов, хорошо растворимы в воде?
- почему среди спиртов нет газообразных веществ?
2. Химические свойства спиртов на примере этанола, ответ подтвердите уравнениями реакций
3. Сравнение химических свойств фенола со свойствами одноатомных спиртов. Ответ подтвердите уравнениями реакций.
4. Способы получения спиртов. Ответ подтвердите уравнениями реакций
5. Проделать качественные реакции на спирты и фенолы, записать схемы соответствующих реакций. Каковы признаки реакций?
6. Изомерия и номенклатура спиртов. Приведите примеры.