Модульная единица 1.2.
«Химическая структура, биологическая роль важнейших молекул жизни. Принципы гормональной и нейромедиаторной регуляции»
Занятие 1.2.2.
Методические указания для студентов
ТЕМА: Аминокислоты, пептиды, белки. Классификация и структура белков
ЦЕЛЬ: Сформировать у студентов знания о строении и биологической роли аминокислот, пептидов и белков, как основу для понимания их метаболических превращений в организме. Познакомить со строением и функциями гормонов, антибиотиков, лекарственных средств пептидной и белковой природы.
ЗНАТЬ: Строение и стереоизомерия важнейших α–аминокислот, входящих в состав пептидов и белков, их сокращенные обозначения, используемые при записи строения пептидных цепей. Биосинтетические пути образования α–аминокислот и α–оксокислот. Реакции дезаминирования, декарбоксилирования, окисления тиольных групп. Пептиды и белки. Строение пептидной группы. Первичная структура. Строение и номенклатура на примере простейших представителей пептидов, гидролиз.
УМЕТЬ: Приводить модели осуществляемых в организме реакций (трансаминирования, восстановительного аминирования, декарбоксилирования) и образования дисульфидных связей (на примере глутатиона). Изображать электронное строение и обосновывать плоскостное расположение пептидной группы. Записывать фрагменты первичной структуры полипептидов в виде последовательно связанных трех-четырех аминокислотных остатков с указанием на наличие пептидных групп, боковых радикалов, N- и C-концевых аминокислот. Применять номенклатуру пептидов. Приводить схемы реакций гидролиза.
ВЛАДЕТЬ: Навыками изображения химической основы осуществляемых в организме реакций- трансаминирования и восстановительного аминирования; декарбоксилирования; окисления тиольных групп. Навыками построения пептидной цепи; изображения электронного строения и пространственное расположение пептидной группы. Навыками применения номенклатуры пептидов.
Исходный уровень
1. α –аминокислоты, входящие в состав пептидов, белков. Строение. Номенклатура. Стереоизомерия. Кислотно-основные свойства, диполярная структура.
2. Классификация α –аминокислот: по химической природе радикала, по кислотно-основным свойствам.
3. Химические свойства α –аминокислот: по аминогруппе (алкилирование, ацилироваение, образование оснований Шиффа); по карбоксильной группе (этерификации, образование галогенангидридов).
4. Биологически важные реакции α –аминокислот (декарбоксилирование, дезаминирование, окислительное дезаминирование).
5. Аналитически важные реакции обнаружения аминокислот (образование внутрикомплексных солей с катионом меди, нингидринная реакция, ксантопротеиновая реакция).
I. Теоретические вопросы
1. Образование пептидов, строение и свойства пептидной связи. Дипептиды, трипептиды, первичная структура белка.
2. Вторичная, третичная, четвертичная структура полипептидов, белков.
3. Функции белков в организме. Денатурация белков. Протеиды и протеины.
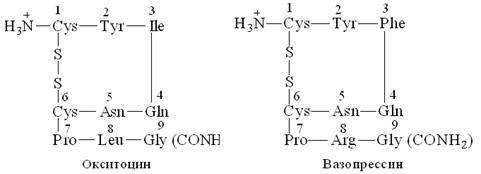
4. Важнейшие пептиды: глутатион, карнозин, 6-аминопенициллоновая кислота, инсулин, окситоцин, вазопрессин, метионин - энкефалин, лейцин - энкефалин.
II. Обучающие упражнения
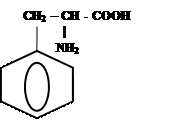
Задание 1. Получите дипептиды, образованные фенилаланином и глицином, назовите их.
Ответ: Из данных аминокислот можно получить четыре дипептида.
1 ) О
∕∕
NН2 – СН2 – СООН + NН2 – СН2 – СООН ↔ NН2 – СН2 - С
-Н2О \
NН-СН2-СООН
Глицил-глицин
2)
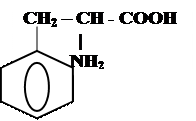 |  | ||
СН2 - СООН ↔
+ | -Н2О
NН2
 лаланил-глицин
лаланил-глицин
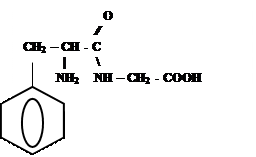
 3)
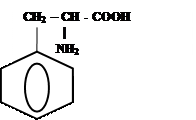
3)
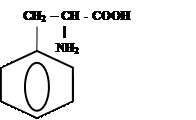 |
+ ↔
-Н2О
Фенилаланил-фенилаланин
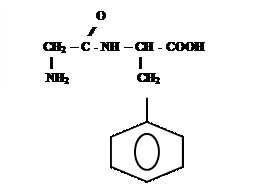
 4)
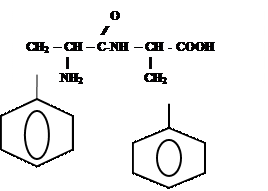
4)
СН2 – СООН
| +
NН2 ↔
-
Глицил-фенилаланин
Задание 2. Каковы особенности строения пептидной связи.
Ответ:
В составе пептидной (амидной) группы -СО-NH- атом углерода в sp2 гибридном состоянии, атом азота тоже в sp2 состоянии, неподеленная пара электронов атома азота вступает в сопряжение с p - электронами двойной связи С=О. Пептидная группа представляет собой трехцентровую p - р сопряженную систему, в которой электронная плотность смещена к кислороду, атомы С,О,N находятся в одной плоскости.
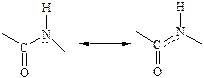
Вращение вокруг связи С-N затруднено, поэтому пептидная группа имеет плоскую, жесткую структуру.
Задание 3. Укажите строение и биологическую роль пептидных гормонов: окситоцина, вазопрессина и инсулина.
Ответ:
Окситоцин и вазопрессин - пептиды, выделяемые задней долей гипофиза. Оба гормона содержат по 9 аминокислотных остатка (нанопептиды). Окситоцин встречается только у женских особей. Он вызывает сокращение гладкой мускулатуры (матки), применяется в гинекологии и акушерстве.
Вазопрессин содержится в женском и мужском организмах. Он регулирует минеральный обмен и баланс жидкости (антидиуритический гормон).
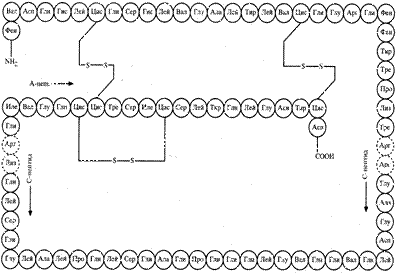
Инсулин – гормон, ответственный за контроль метаболизма углеводов, жиров и белков, вырабатывается поджелудочной железой. Инсулин состоит из 2-х пептидных цепей А и Б, соединённых двумя сульфидными мостиками. Цепь А содержит 21, а Б – 30 аминокислотных остатков. С недостатком инсулина в организме связаны серьёзные нарушения углеводного обмена (сахарный диабет).
III. Задания для самостоятельной работы
Задание 1. Напишите схему образования глутатиона (γ-Глу-Цис-Гли) и его реакцию с гидропероксидом.
Задание 2. Напишите пептиды, которые могут образоваться при взаимодействии триптофана и α-аланина (in vitro).
Задание 3. Приведите систематическое название пептида с историческим названием везуген (Lis-Glu-Asp). Представьте его структуру в ионизированной форме.
Задание 4. Приведите название ряда структурных белков, укажите их роль.
Задание 5. Приведите название некоторых транспортных белков. Укажите, какие белки переносят кислород, ионы меди, железа.