| № | Наименование величины или физический закон | Формула |
| Уравнение состояния идеального газа | 
| |
| Закон Дальтона | Р=Р1+Р2+...+Рn | |
| Основное уравнение кинетической теории газов | 
| |
| Средняя кинетическая энергия молекул (k=1,38×10-23 Дж/К - постоянная Больцмана; i-количество степеней свободы молекулы). | 
| |
| Внутренняя энергия вещества | 
| |
| Средняя квадратичная скорость | 
| |
| Средняя арифметическая скорость | 
| |
| Наиболее вероятная скорость | 
| |
| Средняя длина свободного пробега молекул (d-эффективный диаметр молекулы) | 
| |
| Явления переноса: | ||
| а). уравнение диффузии (закон Фика) | 
| |
| б). уравнение теплопроводности (закон Фурье) | 
| |
| в). уравнение внутреннего трения (закон Ньютона) | 
| |
| Закон Вант-Гоффа для осмоса (Р0-смотическое давление; i - изотонический коэффициент i=1+a, где a-степень диссоциации) | 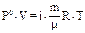
| |
| Интенсивность потока J: | ||
| а). при диффузии | 
| |
| б). при теплопроводности | 
| |
| в). при осмосе | Jос.=A×(P10-P20) | |
| Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) | 
|
| № | Наименование величины или физический закон | Формула |
| Критические параметры (параметры, определяющие критическое состояние газа) | ||
| а). критический объем газа | Vк=3×в×n | |
| б). критическое давление | Рк=а / (27×в2) | |
| в). критическая температура | Тк=8×а / (27×R×в) | |
| Влажность воздуха | ||
| а). абсолютная влажность | fа=m / V | |
| б). относительная влажность | 
| |
| Коэффициент поверхностного натяжения жидкости (F-сила поверхностного натяжения; DЕ - изменение свободной энергии поверхностного слоя) |

| |
| Дополнительное давление, вызванное кривизной поверхности жидкости (формула Лапласа) | 
| |
| Высота поднятия (опускания) жидкости в капилляре (формула Жюрена-Борелли) | 
| |
| Дополнительное давление насыщенного пара над искривленной поверхностью жидкости (r-плотность жидкости, r0-плотность насыщенного пара) |

| |
| Количество теплоты, необходимое для нагревания тела | Q=c×m×DT | |
| Теплоемкость одного моля вещества | ||
| а). при постоянном объеме | 
| |
| б). при постоянном давлении | 
| |
| Уравнение Майера | Ср- Сv=R; 
| |
| Первое начало термодинамики | DQ = DU + DA | |
| Применение первого начала термодинамики к газовым процессам: | ||
| а). изохорический процесс | DА=0; 
| |
| б). изобарический процесс | 
| |
| в). изотермический процесс | DU = 0; 
|
| № | Наименование величины или физический закон | Формула |
| г). адиабатический процесс | DQ = 0; DA = - DU;

| |
| Уравнение Пуассона | Р×Vg = const; T×Vg-1 = const | |
| Термодинамический коэффициент полезного действия | 
| |
| К.П.Д. цикла Карно | 
| |
| Изменение энтропии | 
| |
| Формула Больцмана (Р-термодинамичес-кая вероятность состояния системы) | S = k×lnP | |
| Изменение энтропии в биологических системах | DS = DSi + DSe | |
| Скорость изменения энтропии в организме | 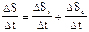
| |
| Скорость изменения энтропии организма в стационарном состоянии | 
|