Лекции 14-15
СУПРАМОЛЕКУЛЯРНАЯ ХИМИЯ
План
I.Задачи и основные понятия супрамолекулярной химии
I.I. Задачи супрамолекулярной химии
I.II. Основные понятия супрамолекулярной химии
I.III. Природа связей в супрамолекулах
II. Молекулярные и супрамолекулярные машины
III. Cупрамолекулярная химия металлоорганических гибридных наночастиц
IV. Принципы работы сканирующих зондовых микроскопов
I.Задачи и основные понятия супрамолекулярной химии
I.I. Задачи супрамолекулярной химии
Существует ряд важнейших задач, развитию которых способствует супрамолекулярная химия. Так, например, одной из таких задач является разработка высокоэффективных селективных реагентов и катализаторов. Знание того, какими замечательными свойствами обладают природные катализаторы и ферменты, служит мощным стимулом для создания их синтетических аналогов из простых молекул с использованием законов супрамолекулярной химии. Дизайн и синтез молекул-рецепторов, способных к селективному связыванию органических и неорганических субстратов за счёт супрамолекулярного комплексообразования, привело к осуществлению селективного транспорта ионов через мембраны. В настоящее время получены и изучены супрамолекулярные системы, в которых происходит эффективный перенос энергии. Известны молекулярные системы, работающие как фотонные преобразующие устройства. Получены также молекулярные провода и каналы, по которым осуществляется транспорт электронов или ионов. Активно разрабатываются также переключающие устройства, используемые в генерации, обработке, передаче и регистрации сигналов. Таким образом, исследования супрамолекулярной химии являются важнейшими для разработки новых технологий катализа, создания сенсоров различного типа, в синтезе новых лекарственных препаратов, оптических устройств и при получении новых миниатюрных приборов для записи и хранения информации.
I.II. Основные понятия супрамолекулярной химии
Супрамолекулярная химия – это химия слабых нековалентных взаимодействий, она включает в своё рассмотрение сложные ансамбли органических молекул. Однако эти взаимодействия являются высокоспецифичными, в основе их лежат процессы распознавания. Важной датой является 1967 г., когда впервые был осуществлен синтез краун-эфиров и открыта их способность образовывать комплексы с катионами металла и катионами аммония (рис. 1). Создание и исследование комплексов таких молекул дало толчок развитию супрамолекулярной химии.

Рис.1. Структурные формулы одного из краун-эфиров и его комплекс с катионом калия
Если молекулярная химия за счёт образования ковалентных связей собирает атомы в одной молекуле, и эта молекула имеет определенную структуру, то органические или неорганические молекулы за счет нековалентных взаимодействий могут собираться в супрамолекулы. Структура такой супрамолекулы называется супраструктура или супрамолекулярная архитектура.
Частицы, которые вступают во взаимодействие друг с другом при образовании супрамолекулы, делятся на рецепторы (или лиганды) и субстраты («гости»). Иногда их называют «гость и хозяин». На рис. 1.3 представлены наиболее известные рецепторы. Это циклические полиэфиры (краун-эфиры), циклические полиамины и другие циклические структуры, например, каликсарены.
Может происходить ассоциация и с полимерными макромолекулами, если они содержат подходящие функциональные группы, например аминогруппы, карбоксильные, карбонильные группы. Известно и очень активно изучается образование комплексов между органическими молекулами (субстраты) и белками (рецепторы). Это процесс называется интеркаляцией.
Образование супрамолекулярных комплексов - это самопроизвольные процессы: смешиваются растворы компонентов, которые самопроизвольно организуются в комплексы с определённой архитектурой. В некоторых случаях образование комплексов требует протекания химической реакции. Так образуются известные комплексы, имеющие в своем составе полипиридиниевые лиганды и двух- или трёхвалентный катион рутения
.

Первые названия были клатраты («молекулы-хозяева» координируют субстрат во внутримолекулярных полостях), кавитаты («молекулы-хозяева» координируют субстрат в межмолекулярных полостях). В последнее время наиболее часто используется такие названия, как соединения включения, комплексы, ассоциаты, соединения типа «гость-хозяин», супрамолекулярные ансамбли.
На рис представлены основные типы комплексов, возникающие между лигандом и субстратом. Образование того или иного комплекса определяется соотношением размеров лиганда и субстрата, а также природой и структурой координирующего центра.

I.III. Природа связей в супрамолекулах
Связывание молекул в ансамбли происходит за счёт нековалентных связей, которыми являются электростатические взаимодействия, водородные связи, ван-дер-ваальсовы силы, стэкинг-взаимодействие, координационные связи. Все межмолекулярные связи отличаются небольшими энергиями образования.
Большую роль при возникновении металлоорганических комплексов играет координационная связь (50-200 кДж/моль). Иногда её называют также донорно-акцепторной связью. При образовании связи один из атомов является донором и имеет электронную пару на внешней оболочке. У акцептора должна быть одна вакантная орбиталь во внешней оболочке. В состав донора входят многие гетероатомы, среди них известными по способности образовывать координационные связи являются атомы кислорода, азота, серы. Акцептором может являться протон, катион металла.

Разновидностью координационных связей считают водородные связи. При образовании водородных связей атомы водорода способны связываться с атомами кислорода, азота, реже фтора, хлора, серы. При этом высвобождающаяся энергия лежит в пределах 4-120 кДж/моль, что заметно ниже химической связи. Роль водородной связи в природе велика. Так, вода, ассоциированная за счёт водородных связей, проявляет специфические свойства, что, в частности, обуславливает роль воды в природе и организмах живых существ. На рис. 1.10 приведены комплексы, в образовании которых участвует водородная связь. Мочевина прочно удерживается гетероароматическим лигандом, причём, видимо, размер координирующей полости лиганда хорошо подходит размеру молекулы мочевины.

При межмолекулярном диполь-дипольном взаимодействии молекулы располагаются так, что положительные концы молекул ассоциируются с отрицательными концами. Энергия диполь-дипольного взаимодействия оценивается в 5-50 кДж/моль. Например, известно образование агрегатов цианиновых красителей за счёт диполь-дипольного взаимодействия:

Силы притяжения и отталкивания могут возникнуть между нейтральными молекулами, не связанными непосредственно между собой. Они называются силами Ван-дер-Ваальса. Данные взаимодействия подразделяют на дисперсионные (силы Лондона) и обменно-отталкивающие. Любая нейтральная молекула под действием внешней среды может в некоторой степени поляризоваться и в поляризованном состоянии взаимодействовать с другой молекулой. Поляризуемость молекулы обусловлена возможностью деформации внешнего электронного облака. В силу пространственно сближенного расположения между поляризованными молекулами может возникнуть притяжение, сопровождающееся выделением энергии. Энергия такого взаимодействия оценивается в 5-20 кДж/моль. Однако сближение молекул на расстояние ближе суммы ван-дер-ваальсовых радиусов приводит к их отталкиванию. Ван-дер-ваальсовый радиус есть половина расстояния между центрами атомов при наибольшем их сближении (рис. 2).

Рис. 2. Схема поляризации и взаимодействия молекул за счёт сил Ван-дер-Ваальса
Наиболее сильно проявляются дисперсные силы в протяжённых молекулах, когда есть возможность многоцентрового взаимодействия. Так, высокая прочность полиэтилена объясняется взаимодействием между полимерными цепями за счёт сил Ван-дер-Ваальса. Комплексы каликсаренов с молекулами толуола являются типичными ван-дер-ваальсовыми комплексами.
В научной литературе можно найти описание ряда других слабых взаимодействий, используемых для построения супрамолекулярных ансамблей. Так, при получении моно- и полислоёв из органических молекул определяющую роль играют гидрофобные взаимодействия. Образование плёнок происходит за счёт выталкивания из воды слабосольватированных гидрофобных молекул.
Вещества, имеющие в структуре как полярные, так и неполярные группы, называются амфифильными. К этой группе принадлежат, например, жиры, фосфолипиды и желчные кислоты (рис.3).

Рис. 3. Схема липидной везикулы, образованой при гидрофобном взаимодействии жирных алкильных хвостов
Вследствие гидрофобных взаимодействий амфифилы при контакте с водой склонны образовывать структуры, у которых площадь контакта неполярной части молекул с водой минимальна. На поверхности воды такие вещества обычно образуют монослойные плёнки, у которых полярные группы ориентированы в воду.
p-p-Стэкинг-взаимодействием называют слабое электростатическое взаимодействие с энергией связи 0-50 кДж/моль, возникающее между кольцами электронно-насыщенного ароматического соединения и соединения, испытывающего недостаток электронной плотности.
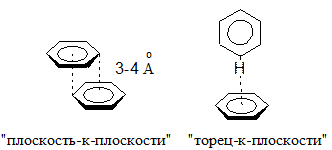
Существуют два основных типа p-p-стэкинг-взаимодействия: «плоскость-к-плоскости» и «торец-к-плоскости». Стэкинг-взаимодействие «плоскость-к-плоскости» обусловлено в основном дисперсионными лондоновскими силами и гидрофобными эффектами. При таком взаимодействии молекулы располагаются параллельно друг другу на расстоянии ван-дер-ваальсового радиуса, приблизительно 3-4 Å. Взаимодействие типа «торец-к-плоскости» можно рассматривать как водородные связи между электрон-дифицитными атомами водорода одного кольца и обогащённым электронным облаком другого. Взаимодействия такого вида обуславливают «ёлочную» упаковку в кристалле.
Распознавание является фундаментальным понятием супрамолекулярной химии. Молекула рецептора на своём молекулярном уровне хранит информацию, которая считывается на супрамолекулярном уровне. Информацией может служить размер, форма, конформация, хиральность, заряд, полярность, липо- или гидрофильность субстрата. Другим термином, используемым при описании супрамолекулярных структур, является комплементарность – взаимное соответствие, обеспечивающее связь дополняющих друг друга структур.
Образование супрамолекулы происходит при соблюдении ряда условий.
1. Пространственная комплементарность, т.е. возможность субстрату подойти к рецептору.
2. Комплиментарность на уровне возможности осуществления взаимодействия. Так, если рецептор положительно заряжен, то субстрат должен обладать отрицательным зарядом. Донор взаимодействует с акцептором, диполь - с диполем.
3. Стабильность молекулярных ансамблей. Поскольку межмолекулярные взаимодействия являются слабыми, то множественность взаимодействий обеспечивает прочность межмолекулярным ансамблям.
4. Эффект растворителя. Важно учитывать эффект среды, поскольку межмолекулярные связи не должны разрушаться при взаимодействии со средой.
5. Распознавание предполагает комплементарность партнеров – геометрическое, природное соответствие.