Степени окисления
1) Степень окисления атомов в простых веществах (например, Fe, Al, O2) равна нулю.
2) Степень окисления атомов в оксидах:
Fe2O3
Степень окисления атомов кислорода в оксидах -2
-2
Fe2O3
У трех атомов кислорода суммарный заряд -6.
-6
-2
Fe2O3
Суммарный заряд все атомов в молекуле равен нулю, поэтому у двух атомов железа суммарный заряд равен +6
+6 -6 = 0
-2
Fe2O3
Поэтому степень окисления атома железа равна +3
+6 -6 = 0
+3 -2
Fe2O3
3) Степень окисления атомов в кислотах:
У атомов водорода степень окисления в кислотах +1, у атомов кислорода -2
+1 -2
H2SO4
У двух атомов водорода суммарный заряд +2, у четырех атомов кислорода суммарный заряд -8:
+2 -8
+1 -2
H2SO4
Суммарный заряд все атомов в молекуле равен нулю, поэтому у серы должен быть заряд (степень окисления) +6:
+2+6 -8=0
+1+6 -2
H2SO4
Двухромовая кислота
+1 -2
H2Cr2O7
У двух атомов водорода суммарный заряд +2, у семи атомов кислорода суммарный заряд -14
+2 -14
+1 -2
H2Cr2O7
Так как суммарный заряд всех атомов в молекуле равен нулю, заряд двух атомов хрома равен +12, а степень окисления одного атома хрома равна +6:
+2 +12 -14=0
+1 +6 -2
H2Cr2O7
4) Степень окисления атомов в основания равна количеству гидроксид-анионов.
+2 +3
Fe(OH)2, Fe(OH)3
Степень окисления азота в аммиаке и в солях аммония равна -3:
-3
NH3
5) Степень окисления атомов в солях такая же, как в соответствующих кислотах и в основаниях:
Дихромат аммония получается при взаимодействии аммиака и двухромовой кислоты:
-3 +6 -3 +6
 2NH3 + H2Cr2O7 (NH4)2Cr2O7
2NH3 + H2Cr2O7 (NH4)2Cr2O7
Окислительно-восстановительные реакции
Окислительно-восстановительными называются реакции, в которых атомы меняют степени окисления. Это возможно в том случае, если одни атомы отдают электроны другим атомам.
|
|
Атом (или молекула), которые принимают электроны, называют окислителями. Атом (или молекула), которые отдают электроны, называют восстановителями.
Окислители восстанавливаются, восстановители окисляются. Окисление – это отдача электронов, а восстановление – прием электронов.
Типичные окислители:
F2, Cl2, Br2, I2, O3 (озон), HNO3, KMnO4 (перманганат калия), K2Cr2O7 (дихромат калия).
Типичные восстановители:
H2, CO, NH3, металлы.
Взаимодействие металлов с кислотами.
1) Соляная кислота взаимодействует с металлами, которые находятся выше водорода в ряду напряжений (приложение 1), при этом выделяется водород.
 Fe + 2HCl FeCl2 + H2
Fe + 2HCl FeCl2 + H2
2) Значительно разбавленная серная кислота взаимодействует с металлами подобно соляной кислоте
 Fe + H2SO4 FeSO4 + H2
Fe + H2SO4 FeSO4 + H2
Концентрированная серная кислота образует другие продукты восстановления (SO2, S, H2S):
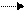 Cu + 2H2SO4 CuSO4 + SO2 + 2H2O
Cu + 2H2SO4 CuSO4 + SO2 + 2H2O
3) Азотная кислота водород не выделяет. Продуктами восстановления являются NO2, NO, N2, NH4NO3 и так далее.
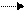 Cu + 4HNO3 (конц.) Cu(NO3)2 + 2NO2 + 2H2O
Cu + 4HNO3 (конц.) Cu(NO3)2 + 2NO2 + 2H2O
Электронный баланс.
Расставить коэффициенты в окислительно-восстановительных реакциях иногда непросто. Можно использовать метод, который называется электронным балансом
Записываем схему реакции без коэффициентов и находим степени окисления:
0 +5 +2 +5 +2
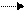 Cu + HNO3 (разб.) Cu(NO3)2 + NO + H2O
Cu + HNO3 (разб.) Cu(NO3)2 + NO + H2O
Составляем так называемые «электронные уравнения»
|
|
Окисление меди, потеря двух электронов:
0 +2
 Cu – 2e Cu
Cu – 2e Cu
Восстановление азота, приобретение трех электронов:
+5 +2
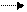 N + 3e N
N + 3e N
Количество принятых и отданных электронов должно быть одинаковым, составляем баланс.
0 +2
 Cu – 2e Cu 3
Cu – 2e Cu 3
+5 +2
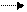 N + 3e N 2
N + 3e N 2
Желтым маркером показаны коэффициенты. Следует отметить, что эти коэффициенты относятся только к атомам, которые меняли степени окисления, например, к атомам азота в оксиде (NO), но не относятся к атомам, которые не меняли степени окисления, например, к атомам азота в нитрате меди.
Рекомендуется подчеркивать вещества, коэффициенты которых мы уже определили:
0 +5 +2 +5 +2
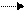 3Cu + HNO3 (разб.) 3Cu(NO3)2 + 2NO + H2O
3Cu + HNO3 (разб.) 3Cu(NO3)2 + 2NO + H2O
Осталось найти коэффициенты еще двух веществ – азотной кислоты и воды. Часть атомов азота в азотной кислоте не восстановилась, они перешли в нитрат меди без изменений. Атомы, входящие в молекулы воды, также не меняли степени окисления.
В правой части находится 8 атомов азота: 6 атомов азота находятся в трех молекулах нитрата меди, а два атома азота – в двух молекулах оксида азота. Отсюда следует, что коэффициент азотной кислоты – 8.
0 +5 +2 +5 +2
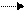 3Cu + 8HNO3 (разб.) 3Cu(NO3)2 + 2NO + H2O
3Cu + 8HNO3 (разб.) 3Cu(NO3)2 + 2NO + H2O
Осталось определить коэффициент воды. Он равен четырем (его можно найти, определив количество атомов водорода в левой части уравнения).
0 +5 +2 +5 +2
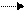 3Cu + 8HNO3 (разб.) 3Cu(NO3)2 + 2NO + 4H2O
3Cu + 8HNO3 (разб.) 3Cu(NO3)2 + 2NO + 4H2O
Получение металлов.
В природе металлы находятся, как правило, в окисленном состоянии, поэтому их нужно восстанавливать.
При восстановлении металлов из оксидов можно использовать такие восстановители, как водород (H2) или угарный газ (CO). Эти процессы происходят при нагревании.
|
|
Например, железо из оксида восстанавливают угарным газом (доменный процесс):
 Fe2O3 + 3CO 2Fe + 3CO2
Fe2O3 + 3CO 2Fe + 3CO2
Вольфрам восстанавливают из оксида водородом:
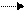 WO3 + 3H2 W + 3H2O
WO3 + 3H2 W + 3H2O
При восстановлении металлов из оксидов использую электролиз (химический процесс, протекающий под действием электрического тока) или действие более активного металла (находящегося в ряду напряжений выше).
Натрий можно получить электролизом расплава соли
электролиз
 2NaCl 2Na + Cl2
2NaCl 2Na + Cl2
Менее активные металлы можно вытеснить из раствора более активными металлами:
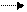 Fe + CuSO4 Cu + FeSO4
Fe + CuSO4 Cu + FeSO4
Влияние кислотности среды.
Катионы водорода, которые образуются при диссоциации кислот, могут участвовать в окислительно-восстановительных процессах, поэтому их концентрация (кислотность среды) может оказывать значительное слияние на характер процесса. Например, перманганат калия в кислой среде образует в качестве продукта восстановления соли двухвалентного марганца, в нейтральной – оксид марганца (+4), а в щелочной среде – манганат калия (K2MnO4).