Предисловие.
Будучи огорчен качеством преподавания химии в РНИИМУ, и тем более, способом последующего контроля качества образования – тестами, я решил оказать посильную помощь студентам в сдаче оных. Пособие представляет собой краткую, насколько возможно, инструкцию, как минимально загрузив голову таки сдать этот окаянный тест. Я исследовал большое их количество, обобщил результаты.
На каждый вид вопросов я постарался дать ответ, в меру научный, чтобы все-таки не слишком уйти от своих химических корней, но и достаточно ясный, чтобы он мог быть воспринят среднестатистическим студентом. Теперь я представляю свой труд для использования широкой общественностью, надеюсь, моё творение сможет послужить к чьей-нибудь пользе.
Тема не имеет прямой привязки к биохимии, и имеет косвенную связь с предстоящими темами. То есть суть такова: понять всё это желательно, но если не получится, то и ладно. Всё равно концепцию механизма органической реакции не понимал никто и никогда в РГМУ-РНИМУ. А некоторые альтернативно одаренные преподы, например, вообще решили провести третью тему раньше второй. Один хуй, никто не заметит, что в третьей теме использованы понятия, введённые во второй, а термин «региоселективность» не объясняется без использования термина «стабильность радикала» или «стабильность карбокатиона». Вокруг ведь лишь тупое быдло, и никто не увидит подвоха, не так ли? Всем бы только баллы за тестики/контрошки.
Конечно, многим хотелось бы иметь готовые ответы и не париться. Думаю, что за годы работы eois общественность накопила некоторый объем ответов, он постепенно совершенствуется, доля верных ответов растет, уже в 2016 она была больше 70%. Правда, обновление вопросов в 2017 добавило веселья. Однако, в отношении химии мне это кажется неудачным путем. Объясню, почему я так считаю. Во-первых, вопросов большое количество, и они, как назло, очень похожи. Это делает трудным списывание с правильных ответов, и, одновременно, делает тесты уязвимыми к методичкам вот такого плана, с разбором вопросов на группы и злой иронией по этому поводу. Во-вторых, некоторые персонажи, как Карина, например, почему-то борются со списыванием, что делает этот процесс не самым простым трюком. А глядя на всё это глобально, по-моему, все же лучше что-то понимать и мыслить, чем списывать.
Заранее благодарен за адекватные комментарии, дополнения и исправления к тексту. Текст создан исключительно из гуманных соображений и распространяется безвозмездно.
Удачи, ни пуха, ни пера, дорогие любители химии.
Алексей «Леша-химик» Федоров,
22.11.2017.
Тема 12. Электронное строение.
Введение:
Не нужно для теста. Тема легко поддаётся систематизации, хотя есть нюансы, о них позже. Разберем только типичные вопросы, а самую мякоть теории, для особо любопытных — в разделе вопросов «верно-неверно».
Типичные вопросы:
1. Гибридизация.
Пример:

Школа-стайл…
Как с этим бороться:
Изи. Если у атома С есть только одинарные связи — он sp3.Если есть двойная или С+(отличие от школы) — то это sp2. Если тройная — то sp. Обратите внимание на группы СООН и СОН, в них С связан с О двойной связью, хоть это и не показано. В примере два С слева связаны друг с другом двойной связью — оба ониsp2. В середине –СН2–, не привязанный к двойным-тройным связям, это sp3-гибридный углерод. Итого, ответ В.
2. Вид сопряжения.
Пример:

Ну тоже норм…
Как с этим бороться:
Тоже несложно.
· π-π. Если в формуле есть двойная—одинарная—двойная связи, то это π-π (читается Пи-Пи) сопряжение. Это может выглядеть по-разному. Например, вот так:
 или так
или так  или вот так
или вот так  , или как-то еще типа этого.
, или как-то еще типа этого.
· р-π. Если в формуле есть двойная—одинарная—один из атомов N, O, S, Cl, Br, C+, C-, C*, то это р-π (читается пэ-Пи) сопряжение. Это может выглядеть, например, вот так:
 , или так
, или так  или вот так
или вот так  , или как-то еще типа этого.
, или как-то еще типа этого.
Главное, чтобы было комбо двойная связь — одинарная связь —атом с неподелённой электронной парой странный короче.
· Нет сопряжения. Казалось бы, всё просто. Если не выполнено ни одно из условий, то — и сопряжения нет. Хуй там плавал. По обычаю, студенты РНИМУ начинают искатьневежливую черную кошку в темной комнате там, где её нет. Тем не менее, всё действительно просто. Если двойных связей нет вообще — не может быть сопряжения (см. скрин). Более оригинальный случай рассмотрен ниже, есть и двойная, и посторонний атом, но стоит обратить внимание, что они находятся не рядом, а через две одинарные связи. В таком случае, сопряжение разорвано этими связями (напомним, нужна именно только одна связь), нет сопряжения.

· Оба вида сопряжения. Если выполнено оба условия, то соответственно, есть оба вида сопряжения. Чаще всего это связано с бензолом. Сам по себе бензол — это π-π сопряжение, так как в нем три двойные чередующиеся связи. Если к бензолу добавлен еще один посторонний атом например, вот так

то в формуле есть и π-π, и р-π сопряжение.
Обратите внимание на этот вопрос и разберитесь подробно, дальше мы будем его использовать.
3. Электронный эффект.
Пример:

…
Как с этим бороться:
Элементарно. В САРС-овской методичке приведена таблица с электронными эффектами. То, что нужно. Открываем, находим, смотрим. Нужно определить эффект группы, обведенной кружком. В таблице радикалы названы как-то странно «алкилы», остальное вроде понятно. Надо хлор — берем и находим там хлор. Тут есть нюанс. Эффекты бывают индуктивный и мезомерный. Индуктивный (I) есть всегда. Мезомерный (М) есть только в сопряженной системе. Например, в скрине система сопряжённая (безол + посторонний атом = р-П сопряжение). Таблица пишет, что у хлора –Iи +М. Так как есть сопряжение, ебанём в ответах оба эффекта. Если же вещество вот такое
 ,
,
то системы сопряжения с хлором нет (см. прошлый вопрос, сопряжение разорвано двумя связями). Нужно только –I. Огромная просьба, не перепутать.
4. Кислотность.
Пример:

Кислоты…
Как с этим бороться:
Следует иметь в виду следующее:
1) Кислоты бывают -ОН, -SHи -СООН, в такой последовательности их сила возрастает. -СООН всегда будет сильнее -ОН, например.
2) Заместители, прикрепленные к кислоте, влияют на её силу. Радикалы (СН3, С2Н5, циклогексан, он рисуется как шестиугольник, но без кружка, прочие радикалы, кроме бензола) понижают силу кислоты. Группы (ОН, NH2, F, Cl, Br, NO2, СООН и бензольное кольцо) повышают силу кислоты. Чем больше групп, тем лучше.
3) Чем больше радикал, тем слабее кислота.
4) Иногда меняют положение группы. Чем ближе группа к кислоте, тем она сильнее.
5) Иногда играют в электроотрицательность. Фтор усиливает кислоты больше, хлор слабее, бром еще слабее, йод самый слабый.
Сравниваем приведенные четыре вещества и находим, чем они отличаются. Их отличия создают разность в кислотности. Впримере четыре кислоты расположены по возрастанию силы. Все кислоты СООН, поэтому сравниваем только заместители. Самая слабая — кислота с большим радикалом, немного сильнее — кислота с маленьким радикалом, еще сильнее — кислота без заместителя (Н не считается), самая сильная — кислота с группой СООН, усиливающей кислотность.
5. Устойчивость аниона О- / заряд на О-.
Пример:

фу…
Как с этим бороться:
Осторожно, дальше идёт абзац бугурта. Если химия вас не интересует, его можно пропустить. Честно должны признаться, мы в некотором тупике. Классическая теория утверждает, что «электронодонорные заместители уменьшают делокализацию заряда, что способствует уменьшению устойчивости. Электроноакцепторные заместители способствуют делокализации отрицательного заряда и повышают устойчивость анионов». На русский язык это переводится примерно так: «Радикалы увеличивают (отрицательный) заряд на анионе, при этом он становится менее стабильным. Всякие там группы уменьшают (отрицательный) заряд на анионе. Забегая вперед, заметим, что набрать десятку нам таки удалось, однако в том варианте на этот вопрос мы ответили так, как вы видите на картинке. Исходя из этого, получается, что введение групп (хлоров) способствовало увеличению заряда. Возможно, имеется в виду, что если уменьшается отрицательный заряд, то увеличивается положительный заряд (похоже, так и было, однако для авторов это непривычная формулировка).
Итого, на основе анализа решённого. Тут приведён ряд как бы кислот с оторванным Н+, у них осталось О-. Чем сильнее исходная кислота, тем меньше заряд на атоме кислорода, и тем устойчивее анион. Схемой: чем ↑кислота, тем ↑заряд, тем ↑устойчивость. В примере четыре кислоты, по мере добавления групп (хлоров) кислоты сильнее, значит, заряд больше.
6. Основность.
Пример:

Снова фигня, как в 4 вопросе…
Как с этим бороться:
Вопрос, обратный к кислотности, даже проще. Основания — только NН2и другие амины. Присоединенные заместители влияют на основность азота в амино-группе.
1) Радикалы (кроме опять-таки бензола) усиливают основность. Естественно, чем больше радикал, тем сильнее основание.
2) Всякие там группы и бензол понижают основность. Чем ближе/дальше группа, тем сильнее/слабее её влияние.
В примере четыре основания расположены по возрастанию силы. Самое слабое основание — NH2 + бензол + альдегид, обе группы понижают основность. Немного сильнее — NH2 + бензол, только одна группа,бензол, понижает основность. Сильнее — циклогексан. Напомним, это шестиугольник без кружка, НЕ бензол. Он считается одним из радикалов, усиливает основность. Самое сильное — два радикала С2Н5, вдвоем усиливают основность наиболее в этом ряду.
7. Заряд на N+ / стабильность катиона N+.
Пример:

…
Как с этим бороться:
Еще более лютая хуита, чем с О-. Мы, признаться, так и не смогли вывести полной зависимости. Бывают с группами СН3 и прочими радикалами или сСF3.СН3 понижают заряд и повышают устойчивость. СF3, наоборот, заряд увеличивают, а устойчивость понижают. Как влияет бензол на катионы в версии eois, мы сказать, к сожалению, не можем.
Расово верная химическая теория утверждает, что «более сильным основаниям соответствуют более устойчивые катионы (иначе — слабые сопряженные кислоты), с меньшим зарядом. Более слабым основаниям — менее устойчивые катионы (иначе — сильные сопряженные кислоты) с большим зарядом. Исходя из этого, бензол должен уменьшать устойчивость. Однако, набрать десятку на таких вопросах мы не смогли, то есть что-то мы недопонимаем.
8. Вещества и рН.
Пример:

ОНО возвращается.рН.
Как с этим бороться:
Вопрос развивает тему кислотности и основности из 4 и 6 вопроса. У кислот рН меньше 7. Чем сильнее кислота, тем рН меньше. В примере две кислоты. Силу их сравниваем как в 4 вопросе. У одной фтор (усиливает больше), поэтому мы ставим ей в соответствие меньшее значение. У второй хлор (усиливает, но слабее), поэтому ставим ей в соответствие большее. У оснований же рН больше 7, и чем сильнее основание, тем больше рН. Силу их сравниваем как в 6 вопросе. Оснований тут тоже два. Циклогексан снова, как радикал, повышает основность (поэтому ему ставим большее значение), бензол же снижает её (меньшее значение).
9. Устойчивость карбокатионов С+.
Пример:
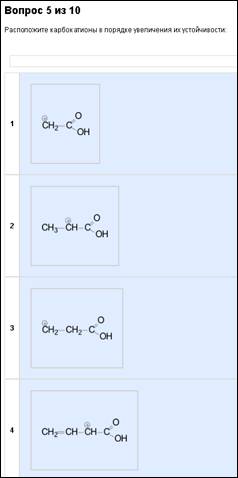
Вот так…
Как с этим бороться:
Примерно похоже на кислотность и основность, но немного более путано. Есть катион С+. То, что к нему прикреплено, влияет на него. СН3 и т.д. радикалы увеличивают устойчивость. Винил
–СН=СН2 усиливает её значительно больше, чем даже несколько СН3. Бензольное кольцо же усиливает её ну просто охуеть как. Неебически усиливает, больше, чем несколько винилов. Группы же (СООН, СF3, NO2 и т.п.) снижают устойчивость. Положение, конечно же, тоже влияет. В примере четыре радикала расположены по возрастанию силы. Самый нестабильный — катион С+ с прикрепленной группой СООН. Так себе катион, что уж там, совсем нестабильный. Чуть стабильнее — катион и слева СН3 (вот она повышает) и справа СООН (понижает, как у первого вещества). Стабильнее — та, где катион не связан с СООН напрямую, а через как бы тот же самый СН3 (то есть СН2). Наиболее удачный случай — катион с винильной группой, четвертый. Напомним, винил сильно повышает устойчивость. С винилом не критично даже прямое соседство с СООН. Винил тащит. Такие дела.
10. Верно - неверно.
Пример:

Кафедра ОБО Химии против химии… с кем не бывает)
Как с этим бороться:
Как всегда, никак. Кое-что из перечисленных утверждений уже было в предыдущих вопросах, но это меньшая часть, и формулировки были упрощены, а тут это не подходит. Как всегда, приводим только верные утверждения. Мы проверили применимость Второго Закона Марии Подмарёвой, и ответственно заявляем: применяется. Всегда должно быть два верных и два неверных утверждения. Как видно из картинки, местами даже можно найти ошибки (электронодонорные стабилизируют катионы, а не анионы), но Второй Закон выполняется (на этом варианте теста десятку получить удалось). Итак, перечень утверждений:
· Электронодонорные заместители стабилизируют катионы и усиливают основания.
· Электронакцепторные заместители стабилизируют анионы и усиливают кислоты.
· Чем выше делокализация положительного заряда, тем устойчивее катион, да и анион тоже устойчивее.
· Чем слабее кислота, тем сильнее сопряженное основание.
· Сила кислоты X–H зависит от природы кислотного центра и устойчивости сопряженного основания
· Основные свойства проявляют не только анионы (но и нейтральные молекулы).
· Чем сильнее кислота, тем меньше ее значение p Ka.
· Чем сильнее основание, тем больше ее значение p KВН+.
· Размер атома, связанного с водородом в кислотном центре, влияет на кислотность.
· Число р -электронов в ароматической системе определяется формулой 4n-2.
· Ароматическим является НЕ любое соединение, имеющее замкнутую цепь сопряжения.
· Ароматическими могут быть только циклические соединения
· Насыщенные соединения НЕ могут быть ароматическими.
· Ароматичность проявляется только при наличии замкнутой цепи сопряжения
· Сопряжение возникает в результате перекрывания π -связей
· p,p -сопряжение возникает в результате взаимодействии р -орбиталейсоседних p -связей.
*БЛЯДЬ! В eois неудачный шрифт (Calibri), в котором буквы π и р нихуя не отличаются. Вероятно, когда текст копировали, не обратили внимания. Если перевести этот текст в TimesNewRoman, получится «p,p -сопряжение возникает в результате взаимодействии р -орбиталей соседних p -связей». В таком представлении верность утверждения становится очевидной, ведь p,p -сопряжение и должно получаться от соседства p -связей. p, а не р-связей, которых и не существует!
· p K BH+= 14 – p K B
· Амины проявляют более сильные основные свойства, чем спирты.
· R-OH более слабая кислота, чем R-SH (при одинаковых R)
· Кислотность карбоновых кислот выше кислотности фенолов.
· Индуктивный эффект быстро затухает по цепи σ -связей. А мезомерный распространяется далеко по сопряженной системе.
· Ароматические амины проявляют более слабые основные свойства, чем алифатические
· Электроноакцепторные группы в бензольном кольце повышают кислотность фенолов.
· Сопряженные радикалы более устойчивы, чем несопряженные
· Атомы галогена в галогензамещенных кислотах проявляют только индуктивный, без мезомерного, эффект
· Арильный и винильный радикалы могут обладать НЕ только + М эффектом.
· Устойчивость насыщенных свободных радикалов увеличивается с увеличением числа заместителей у радикального центра
· Мезомерный эффект возможен только в сопряженных системах.
· И многое, многое другое.
Отдельную проблему представляет контрольная. С одной стороны, мы считаем контрольные достойным видом мероприятия, и глумиться над ними не собираемся. С другой — всё равно мало кто понимает, что происходит. И с третьей стороны — нет материалов для анализа, разбирать, собственно, и нечего. Тем не менее, проанализируем то, что есть, кратко и тут. Контрольная, по нашим наблюдениям, состоит из двух вопросов. Первый посвящен кислотам. Сравнить там предлагают две кислоты, и это очень похоже на упрощенный 4 вопрос, с одним нюансом: формул нет. Неимоверным усилием вспоминаем прошлую тему, номенклатура. Если не поможет — есть Гугл в помощь, любую трифторуксусную кислоту можно найти там. Чтобы сравнить силу кислот, просто прикинем, где там радикалы (ну или электронодонорные заместители (ЭД), как вы уже догадались) — ослабляют. Электроноакцепторные (ЭА, группы, да) — усиливают. Особенность контрольной — рядом с заместителями желательно писать ЭД или ЭА, так будет выглядеть умнее. Крайне желательно обозначать электронные эффекты. Это похоже на третий вопрос, но сложнее и с рисованием. И на группы молекула предварительно не разбито, надо делать это самим. Индуктивный эффект обозначается прямой стрелкой по связи, мезомерный — изогнутой над связью. Если у группы положительный эффект, то стрелка идёт от группы, если отрицательный — к группе. Грубо, конечно. Индуктивный нужен всегда, мезомерный — только в сопряженных. Например:
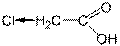
Хлор не входит в систему сопряжения, хотя она тут и есть. Таблица утверждает, что у хлора –I, +M. Индуктивный рисуем прямой стрелкой по линии связи, к хлору, потому что он отрицательный. +М мы выкинули, нет сопряжения. А вот другой пример:

У группы NH2 тоже есть –I, +M. Тут, однако, она входит в систему сопряжения, поэтому мы рисуем и прямую стрелку к группе (–I), и изогнутую стрелку над связью, направленную от группы в сторону всей остальной формулы(+M). Хотя смысл этого действия не вполне понятен, оставим как есть. Затем, как написано в верно/неверно, нужно соотнести рКа с кислотой. Напомним, что чем сильнее кислота, тем меньше константа. Затем нужно посчитать рН — формула аж из первого колка. И сопряженное основание — оттуда же. Второй вопрос контрольной похож на первый, но касается оснований. Всё аналогично, подробнее рассмотрите шестой вопрос теста. Обозначение электронных эффектов аналогично кислотам.
Теорию на себе мы проверили, но полных зависимостей, признаемся честно, вывести не получилось.
Спасибо за внимание!