Это вещество так необходимо человеческому роду,
что даже духовные удовольствия не могут быть лучше выражены,
как словом «…» - таково имя, данное всем проявлениям острого ума.
Плиний-Старший
В древней раздробленной Германии наличие соляных источников на той или иной территории считалось вполне достаточным и убедительным поводом для военного вторжения соседей.
Легионерам Древнего Рима часто платили жалование не деньгами, а солью. Слово «солдат» и английское слово “salary” (жалованье) родились благодаря такому «жалованью».
В XIII в., по свидетельству Марко Поло, в Тибете монетой служила лепёшка из соли с оттиснутым на ней изображением «великого хана», а по словам М. В. Ломоносова, ещё и в его время за 4-5 плиток «Горной соли» в Абиссинии можно было купить раба.
Соли – это сложные вещества, состоящие из ионов металла и ионов кислотного остатка. Соли – это твёрдые вещества, они отличаются между собой окраской и растворимость в воде.

Ещё в начале XIX в. шведский химик Й.Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте на металл.
По этим признакам соли делят на средние, кислые и основные.
 Средние соли – это продукты полного замещения атомов водорода в кислоте на металл. Именно эти соли вам уже известны. Например, Na2CO3 – карбонат натрия
Средние соли – это продукты полного замещения атомов водорода в кислоте на металл. Именно эти соли вам уже известны. Например, Na2CO3 – карбонат натрия
Al2(SO4)3 – сульфат алюминия
Ba(NO3)2 – нитрат бария
CaCl2 – хлорид кальция
K3PO4 – фосфат калия
Эти соли диссоциируют на катионы металла и анионы кислотного остатка. Так, карбонат натрия диссоциирует на катион натрия и карбонат-ион, сульфат алюминия диссоциирует на катион алюминия и сульфат-ион, нитрат бария диссоциирует на катион бария и нитрат-ион, хлорид кальция – на катион кальция и хлорид-ион, а фосфат калия диссоциирует на катион калия и фосфат-ион.
Na2CO3 = 2Na+ + CO32-
Al2(SO4)3 = 2Al3+ + 3SO42-
Ba(NO3)2 = Ba2+ +2 NO3-
CaCl2 = Ca2+ + 2Cl-
K3PO4 = 3K+ + PO43-
Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.


К кислым солям относят такие соли как NaHSO4, KHCO3, CaHPO4.
Название этих солей складывается из названий средних солей с прибавлением слова «гидро».
Назовём наши соли:
NaHSO4 – гидро сульфат натрия
KHCO3 – гидро карбонат калия
CaHPO4 – гидро фосфат кальция
Эти соли диссоциируют ступенчато.
На первой ступени образуется катион металла и анион кислотного остатка, содержащий ион водорода, а
на второй ступени отщепляется ион водорода и кислотный остаток.
NaHSO4 = Na+ + HSO4-
HSO4- ↔ H + SO42-
Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
К таким солям относится малахит, формула которого (CuOH)2CO3.
Как видите, это соль состоит из двух гидроксокатионов CuOH+ и двухзарядного аниона кислотного остатка СО32-. Если подсчитать сумму зарядов ионов, то получается, что эта соль электронейтральна.
Названия основных солей складывается из названия средней соли с добавлением слова «гидроксо».
Например, назовём соли: (CuOH)2CO3, Mg(OH)Cl.

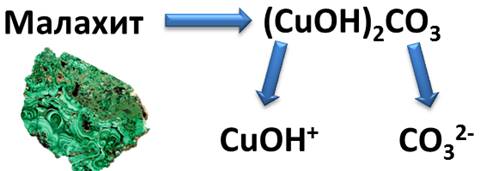
(CuOH)2CO3 – гидроксо карбонат меди (II)
Mg(OH)Cl – гидроксо хлорид магния
Эти соли также диссоциируют ступенчато:
сначала отщепляется катион металла, содержащий гидроксогруппу и
анион кислотного остатка, а затем отщепляется катион металла и гидроксогруппа.
Mg(OH)Cl = MgOH+ + Cl-
MgOH+ ↔ Mg2+ + OH-