М. В. Медведева
ОСНОВНЫЕ ПРИНЦИПЫ
КОЛОНОЧНОЙ ХРОМАТОГРАФИИ
ГЕЛЬ-ФИЛЬТРАЦИЯ
Учебно-методическое пособие
для практических занятий по разделу «Современные методы биохимии»
Москва
УДК 577
ББК 28.072
М42
Рекомендовано к опубликованию решением Ученого и Учебно-методического советов биологического факультета МГУ имени М.В. Ломоносова.
Рецензенты:
Гусев Н.Б., чл.-корр. РАН, доктор биологических наук, профессор, заведующий кафедрой биохимии биологического факультета МГУ имени М.В. Ломоносова
Евстафьева О.Л., кандидат биологических наук, доцент кафедры биохимии ГОУ ВПО Московский государственный медико-стоматологический университет Федерального агентства по здравоохранению и социальному развитию.
Пособие в первую очередь предназначено для студентов 3-го курса кафедр биофизики, биоинженерии, иммунологии и физиологии животных, выполняющих практические работы в рамках раздела «Современные методы биохимии». Пособие также может быть полезно для студентов других кафедр биологического факультета МГУ, осваивающих биохимические методы исследования.
ISBN 978-5-91587-058-0
ОГЛАВЛЕНИЕ
| ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ………………………………… 1. Общие принципы хроматографии. …………………..... 2. Гель-хроматография. …………………………………… 2.1. Принцип метода гель-хроматографии. ……….. 2.2. Применение гель-хроматографии. ……………. 2.2.1. Разделение групп веществ. ………………. 2.2.2. Фракционирование «с высоким разрешением»............................................. 2.3. Сорбенты для гель-хроматографии. ………….. 2.4. Подготовка носителя к работе. ……………….. 2.5. Заполнение колонки, нанесение разделяемых веществ и их элюция. ………………………….. 2.6. Регенерация носителя. ЦЕЛЬ РАБОТЫ…………………………………………………... ЗАДАЧИ РАБОТЫ………………………………………………. Некоторые сведения о разделяемых веществах. ………………. ПРАКТИЧЕСКАЯ ЧАСТЬ ……………………………………… ОФОРМЛЕНИЕ ЗАДАЧИ ………………………………………. ЛИТЕРАТУРА …………………………………………………… |
|
|
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
В данном методическом пособии мы не ставим целью провести подробный анализ теории хроматографии, а остановимся лишь на тех понятиях и принципах, которые будут непосредственно использованы в практической работе.
1. Общие принципы хроматографии.
Под хроматографическим процессом (хроматография от греч. хрома – цвет) обычно подразумевают процесс движения и последующего разделения смеси веществ в системе, состоящей из двух фаз: неподвижной фазы (которая бывает твердой или жидкой) и подвижной фазы (может быть жидкой или газообразной). Подвижная фаза движется относительно неподвижной с определенной скорость и в определенном направлении. При этом молекулы фракционируемой смеси веществ распределяются между этими фазами в зависимости от своих свойств.
Существует несколько основных способов проведения хроматографического разделения, среди которых:
1) тонкослойная хроматография на пластинах
2) хроматография на бумаге
3) хроматография в объеме
4) колоночная хроматография.
Первые два способа, как правило, применяют для разделения низкомолекулярных соединений, таких как аминокислоты и короткие пептиды, нуклеотиды, липиды и т.п.
|
|
Хроматография в объеме (подробнее см. в методичке «Методы разделения и очистки белков») применима для любого вида хроматографии, за исключением гель-фильтрации (см. ниже).
Наиболее часто и широко используют различные виды колоночной хроматографии. Самая простая колонка представляет собой пластиковую или стеклянную трубку со специальным фильтром на дне, задерживающим сорбент (адсорбент), которым заполняют колонку (рис. 1а). Сорбент представлен частицами геля разной химической природы, и поскольку он неподвижен, является неподвижной фазой. С помощью перистальтического насоса на колонку (обычно в верхнюю её часть) подают жидкость, которая свободно движется между частицами, являясь подвижной фазой – элюентом (рис. 1а). В современной колонке герметичность создается за счет адаптеров – специальных поршней, которые плотно прилегают к ее стенкам, и через которые происходит подача раствора (рис. 1б).
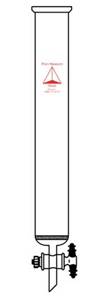

а б
Рис. 1. Хроматографическая колонка: а - общий вид [https://www.prismreseachglass.com]; б – современная колонка с адаптерами [https://images.google.ru].
Хроматографируемые вещества наносят на колонку (наслаивая, или с помощью перистальтического насоса) и подают на неё элюент, который может захватывать вещества и обеспечивать их перемещение по колонке, т.е. процесс элюции. Существует несколько вариантов поведения веществ в колонке: 1) все молекулы веществ не взаимодействуют с сорбентом и двигаются по колонке с той же скоростью, что и элюент; 2) вещества прочно взаимодействуют с сорбентом и не могут быть «смыты » - элюированы – элюентом данного состава, сколько бы его не пропустили через колонку; 3) вещества с умеренной интенсивностью взаимодействуют с сорбентом и продвигаются по колонке с элюентом, но значительно медленнее, чем его основной поток, и в конечном итоге также «выходят» с колонки; 4) часть веществ прочно связывается с сорбентом, в то время как другие постепенно элюируются с колонки; или, напротив, 5) часть веществ не задерживается на колонке и движется со скоростью элюента, тогда как остальные вещества элюируются постепенно; 6) часть веществ прочно связывается с сорбентом, а другие вещества с ним не взаимодействуют вовсе. С точки зрения разделения веществ первый и второй варианты развития событий не приемлемы. Все остальные варианты могут быть использованы при хроматографии.
|
|
Время, в течение которого молекулы находятся в адсорбированном состоянии, определяется прочностью взаимодействия с сорбентом. При этом нанесенные на колонку вещества непрерывно распределяются между двумя фазами – подвижной и неподвижной. Очевидно, что общее количество вещества, подвергающегося хроматографии (М) равно
Мs + Мm = М, (1)
где Мs - количество вещества, связавшегося с сорбентом
(моль или мг)
Мm - количество вещества, не связавшегося с сорбентом
(моль или мг).
Скорость миграции веществ определяться коэффициентом распределения (К), который равен отношению связавшегося с сорбентом вещества к количеству вещества, оставшегося в подвижной фазе:
Мs
К = ¾¾, (2)
Мm
Если это соотношение для компонентов исходной разделяемой смеси не одинаково, то они мигрируют с разными скоростями и их удается отделить друг от друга. При разделении смеси веществ важно подобрать подвижную и неподвижную фазы так, чтобы коэффициенты распределения компонентов смеси в них были различными. Если молекулы вещества совсем не сорбируются на неподвижной фазе, то К=0, а если вещество практически полностью на ней сорбируется - К®¥. Для веществ с промежуточными свойствами величина К может принимать любые положительные значения от 0 до ¥.
Движение единичных молекул двух веществ (А и Б) с различными коэффициентами распределения схематично представлено на рис. 2а. Естественно, что на практике в колонку не вводятся одиночные молекулы. Средние скорости перемещения отдельных молекул одного и того же вещества немного различаются (согласно распределению Гаусса) (рис. 2б), поэтому молекулы разделяемых веществ – сорбатов – «выходят» (элюируются) с колонки не одновременно, а в течение определенного промежутка времени в некотором объеме. Эти объемы и соответствующие им участки длины колонки, равно как пятна и полосы на хроматографической пластине называются хроматографическими зонами, а различие скоростей перемещения одинаковых молекул – размыванием хроматографической зоны. Это нежелательное явление приводит к тому, что если на колонку нанести два сорта молекул А и Б, то среди молекул Б могут находиться молекулы А (рис. 2б), скорость движения которых близка к скорости наиболее «быстрых» молекул Б. В результате зоны А и Б могут частично перекрываться, и разделение окажется неполным (рис. 2б). Чтобы свести размывание зон к минимуму, используют различные технические и методические приемы как на стадии изготовления хроматографического оборудования, так и на стадии непосредственно хроматографического разделения.
а
б
Рис. 2. Схематичное отображение поведения молекул двух различных веществ ( - А и
- А и 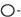 - Б) при колоночной хроматографии (см. объяснения в тексте) [https://www.chromatogramma.ru/book/2009/06/05/teoreticheskie-osnovy-khromatogra…].
- Б) при колоночной хроматографии (см. объяснения в тексте) [https://www.chromatogramma.ru/book/2009/06/05/teoreticheskie-osnovy-khromatogra…].
Размывание хроматографической зоны на «выходе» с колонки приводит к постепенному нарастанию концентрации сорбата в элюенте до некоторых максимальных значений, которые значительно меньше концентрации этого же вещества на «входе» в колонку, и таким же постепенным спадом концентрации до нулевого уровня. Такие единичные концентрационные зависимости для каждого разделяемого вещества в реальном времени называются хроматографическими пиками, а точкас наибольшей концентрацией вещества – максимумом пика (рис. 3).
В идеальном случае пик имеет колоколообразную форму, описываемую кривой статистического распределения Гаусса. Однако на практике это далеко не всегда так. Чаще пик имеет более или менее значительные отклонения от классической формы. Это явление называется асимметрией пика и при хроматографическом разделении крайне нежелательно. Причин такой асимметрии существует множество, но чаще всего она связана с наличием помимо основного механизма сорбциидополнительных взаимодействий вещества с носителем, а также с наличием в разделяемой смеси разных форм одного и того же сорбата, которые способны превращаться друг в друга в соответствии с константой равновесия между этими формами. На практике это наиболее часто приводит к затянутому
Конц-ция (отн. ед)
Время элюции (мин) / Объем элюции (мл)
Рис. 3. Хроматограмма разделяемых на колонке соединений с пиками их элюции (1-3). По оси абсцисс откладывают время элюции, объем элюции или номер фракции; по оси ординат – концентрацию разделяемых веществ по ходу хроматографии или величины, им пропорциональные, например, оптическое поглощение элюента (по [https://krauthammerlab.med.yale.edu…] с изменениями).
заднему фронту пика, который на хроматографическом «сленге» называют «хвостом», что может существенно сказаться на качестве разделения веществ. В этом случае устранить асимметрию пика можно, кардинально изменив свойства хроматографической системы, например, откорректировав состав элюента и/или подобрав другой сорбент. Гораздо реже происходит уширение переднего фронта (на сленге – «борода», «живот», «нос»), одной из причин которого может быть перегрузка сорбента разделяемым образцом. В этом случае достаточно снизить количество наносимой на колонку смеси веществ, чтобы пик приобрел классическую форму.
Совокупность всех пиков разделяемых веществ, полученных в результате хроматографии, представляет собой профиль элюции (рис. 3), аего графическое изображение называется хроматограммой. При идеальном разделении каждому пику на хроматограмме соответствует одно индивидуальное вещество, первоначально присутствующее в смеси.
Как уже отмечалось, за процессом элюции следят, измеряя концентрацию исследуемого вещества на «выходе» из колонки, если это возможно, по изменению оптической плотности элюента. В начале хроматографии, когда вещество еще не начало элюироваться, или в конце хроматографии, когда вещество уже проэлюировано с колонки, его концентрация в элюате будет равна нулю, и поэтому на хроматограмме будет регистрироваться нулевая или базовая линия. Площадь, ограниченная на хроматограмме пиком и базовой линией, является количественной мерой содержания данного компонента в смеси.
Время, прошедшее с момента начала разделения до появления максимума пика на хроматограмме называют временем удержания tr. Эта величина наряду с шириной и формой пика является основной характеристикой, на базе которой проводят идентификацию вещества на хроматограмме и оценивают качество разделения. Другой важной характеристикой хроматографии является удерживаемый объем – объем элюента, который необходим, чтобы элюировать («вымыть») с колонки данное вещество i. Эту величину легко рассчитать по формуле (3), зная объемную скорость движения элюента в колонке (мл/мин или мл/час) и время удержания вещества i:
Vi = v • tr (3)
где Vi – удерживаемый объем вещества (мл)
tr – время удержания вещества на колонке (мин или час)
v – скорость элюции (мл/мин или мл/час)
Хотя сорбент и растворитель распределены по всей колонке равномерно, колонку можно представить как совокупность дискретных слоев, в каждом из которых устанавливается равновесие в распреденении вещества между подвижной и неподвижной фазами. Такой воображаемый элемент колонки называется «теоретической тарелкой ».
Размывание хроматографической зоны приводит к уширению пика на хроматограмме. Степень размывания количественно характеризуется величиной эффективности, т.е. способностью к образованию узкой концентрированной зоны индивидуального компонента разделяемой смеси в выбранных условиях для данного сорбента. Эффективность разделения зависит от так называемого числа теоретических тарелок N. Величину эффективности N рассчитываются по формулам (4) и (4а):
N = 16(tr/Wb)2 = 5,545 (tr/Wh)2 (4)
или
N = 5,545 (tr/Δtx)2 (4а)
где tr – время удержания пика вещества
Δtx – время элюции пика от половины его высоты на подъеме до половины высоты на спаде (полуширина пика)
Wb – ширина пика на его полувысоте
Wh – ширина пика у основания
Высоту, эквивалентную теоретической тарелки Н, можно рассчитать по формуле (5), зная длину колонки:
Н = L/N (5)
где L – длина колонки
N – число теоретических тарелок
Обе величины N и Н имеют вероятностно-статистический характер и вполне конкретный физический смысл, который можно определить для N как число элементарных актов сорбции-десорбции, произошедшей с веществом при его движении по колонке, а для Н – как высоту слоя в колонке, на котором происходит единичный акт сорбции-десорбции. Из формулы (5) следует, что эффективность прямо пропорциональна длине колонки.
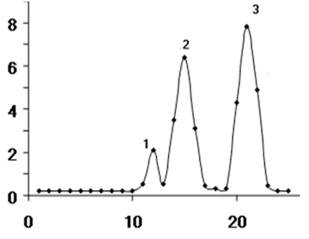
Представим, что 256 идентичных молекул вещества А, которые равномерно распределяются между подвижной и неподвижной фазами, нанесены на колонку с 20 теоретическими тарелками (табл. 1). В верхней (начальной) теоретической тарелке 256 молекул распределяются так, что в каждой фазе находится по 128 молекул. При переходе подвижных молекул с первой теоретической тарелки на вторую, они распределяются на ней по 64 в подвижной и неподвижной фазах. Оставшиеся на первой теоретической тарелке 128 молекул неподвижной фазы в силу динамического равновесия перераспределяются по 64 в каждой фазе, как показано в таблице 1. При продвижении подвижной фазы еще на одну теоретическую тарелку снова происходит перераспределение. Распределение вещества А по колонке в подвижной фазе после 20 последовательных переносов представлено на рисунке 4 (правый пик).
Одновременно с молекулами вещества А на колонку нанесем также 256 молекул другого вещества Б, сродство которого к неподвижной фазе существенно выше, и его молекулы распределяются между подвижной и неподвижной фазами в соотношении 1:3. Из таблицы 1 и рисунка 4 видно, что в результате 20 переносов молекулы вещества Б будут по-другому распределяться по колонке. В результате можно достичь существенного разделения веществ А и Б в процессе хроматографии. Очевидно, что чем больше число теоретических тарелок (т.е. длина колонки), тем лучше разделяются молекулы веществ А и Б на колонке (в том случае, когда разделение определяется только распределением). Так увеличение высоты колонки в 2 раза приводит к улучшению разделения пиков в 1,4 раза, т.е. на 40%.
На эффективность разделения в первую очередь влияют:
1) Основные свойства применяемого сорбента и качество заполнения колонки.
2) Условия хроматографии: температура, скорость потока элюента, его состав и химическое строение разделяемых веществ. На прохождение акта сорбции-десорбции нужно определенное время. По этой причине, чем больше скорость потока элюента, тем больше размывание. Понижение температуры и увеличение молекулярной массы сорбатов будет замедлять установление равновесия. Поэтому
Таблица 1. Принцип действия колонки, в которой разделение основано на распределении*.
| 1-й перенос | 2-й перенос | 3-й перенос | ||||||||||
| № теор. тар-ки | Исходно 256 молекул | Исходно 256 молекул | Исходно 256 молекул | Исходно 256 молекул | Исходно 256 молекул | Исходно 256 молекул | ||||||
| 1:1 | 1:3 | 1:1 | 1:3 | 1:1 | 1:3 | |||||||
| п.ф. | н.ф. | п.ф. | н.ф. | п.ф. | н.ф. | п.ф. | н.ф. | П.ф. | н.ф. | п.ф. | Н.ф. | |
| 64 | 192 | 48 | 144 | 36 | 108 | |||||||
| 16 | 48 | 24 | 72 | |||||||||
| 4 | 12 |
| 8-й перенос | 13-й перенос | 20-й перенос | ||||||||||
| № теор. тар-ки | Исходно 256 молекул | Исходно 256 молекул | Исходно 256 молекул | Исходно 256 молекул | Исходно 256 молекул | Исходно 256 молекул | ||||||
| 1:1 | 1:3 | 1:1 | 1:3 | 1:1 | 1:3 | |||||||
| п.ф. | н.ф. | п.ф. | н.ф. | п.ф. | н.ф. | п.ф. | н.ф. | П.ф. | н.ф. | п.ф. | н.ф. | |
| 9 | 25 | 2 | 6 | 0 | 0 | |||||||
| 21 | 60 | 10 | 30 | 1 | 6 | |||||||
| 20 | 60 | 15 | 46 | 5 | 17 | |||||||
| 10 | 32 | 14 | 42 | 10 | 30 | |||||||
| 4 | 11 | 12 | 35 | 12 | 36 | |||||||
| 1 | 2 | 6 | 14 | 12 | 36 | |||||||
| 0 | 1 | 3 | 8 | 10 | 31 | |||||||
| 1 | 4 | 7 | 19 | |||||||||
| 1 | 2 | 4 | 11 | |||||||||
| 2 | 4 | |||||||||||
| 1 | 3 | |||||||||||
* Гипотетическая колонка разделена на 20 теоретических тарелок. На колонку нанесено 512 молекул. Из них 256 молекул вещества А, которые распределяются между подвижной (п.ф.) и неподвижной (н.ф.) фазами в соотношении 1:1 (жирный шрифт) и 256 молекул вещества Б, которые распределяются между подвижной и неподвижной фазами в соотношении 1:3 (курсив). В процессе элюции оба вещества в подвижной фазе переходят на следующую теоретическую тарелку. После каждого переноса число молекул веществ А и Б распределяется между подвижной и неподвижной фазами в соотношении 1:1 и 1:3, соответственно. Незначительное отклонение общего числа молекул от их суммарного количества связано с округлением цифр при расчетах. Подробные объяснения см. в тексте.
Число молекул
Число теоретических тарелок
↑
Начало хроматографии
Рис. 4. Распределение молекул двух различных веществ А и Б по гипотетической хроматографической колонке, состоящей из 20 теоретических тарелок, после 20 переносов по [https://www.connecticutvalleybiological.com] с изменениями. (См. объяснения в тексте).
при понижении температуры или при разделении веществ с большой молекулярной массой приходится уменьшать скорость элюции.
3) Пристеночный эффект, заключающийся в том, что скорость потока элюента у стенок колонки гораздо ниже, чем в ее центре (поэтому профиль скоростей элюента по сечению колонки имеет форму параболы).
4) Система каналов, образуемых сорбентом в колонке, через которые и протекает элюент. Чем мельче и ближе друг к другу по размерам частицы сорбента, тем более одинаковые пути проходят в колонке молекулы элюента и, соответственно, меньше разница во времени для проходящих через колонку молекул одного компонента.
5) Продольная и поперечная диффузия разделяемых веществ в подвижной и неподвижной фазах, влияющая на скорость единичного акта сорбции, особенно при наличии тупиковых пор в сорбенте (по этой причине, чем больше скорость тока, тем меньше размывание).
6) Особенности конструкции колонки, соединительных узлов, шлангов и кювет детектора, регистрирующего концентрацию вещества в элюате. Эти факторы обуславливают внеколоночное размывание хроматографических зон и также снижают общую эффективность разделения.
В зависимости от принципов разделения веществ выделяют несколько основных типов хроматографии (деление достаточно условно). Это адсорбционная, распределительная, ионообменная и аффинная хроматографии (принципы этих видов хроматографий подробно изложены в методическом пособии «Методы разделения и очистки растворимых белком»), а также гель-хроматография.
Гель-хроматография.
Более 40 лет гель-хроматография играет ключевую роль в очистке белков, полисахаридов и нуклеиновых кислот, поскольку является наиболее простым и «мягким» способом хроматографического разделения, практически нечувствительным к колебаниям рН, концентрации ионов металлов, коферментов и т.п. В зависимости от требований эксперимента разделение можно проводить в присутствии необходимых для биомолекул ионов и кофакторов, детергентов, мочевины, гуанидинхлорида, при высокой и низкой ионной силе, при температуре от 0 до 370 С (и даже выше).
2.1. Принцип метода гель-хроматографии. Гель-хроматография не предполагает специфического сродства вещества к неподвижной или подвижной фазам (более того, связывание разделяемых веществ с сорбентом крайне нежелательно), и в отличие от всех других видов хроматографий, перечисленных выше, разделяемые молекулы при гель-хроматографии не связываются с носителем.
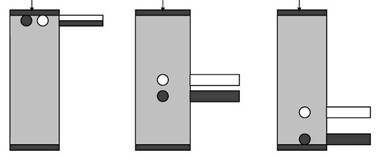
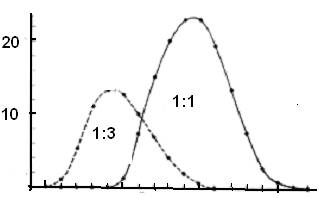
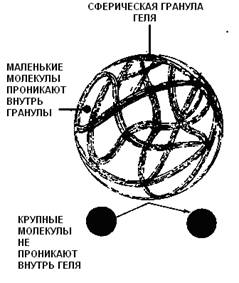
Колонку заполняют сферическими гранулами сорбента, которые формируются из гидрофильного полимера, образующего пространственную сетку (рис. 5б) и обладающего химической и физической стабильностью и инертностью (в первую очередь, у него должны отсутствовать адсорбционных свойств). Носитель уравновешивают буфером или другим раствором, который заполняет как сами пористые гранулы, так и пространство между ними. Размер пор зависит от типа гелей и определяется частотой поперечных сшивок полимера. Внутри гранул постоянно остается жидкость, которая не «увлекается» потоком элюента. Таким образом, при гель-хроматографии неподвижная фаза представлена жидкостью, находящейся внутри пористых гранул, а подвижная фаза - той же самой жидкостью, протекающей между ними.
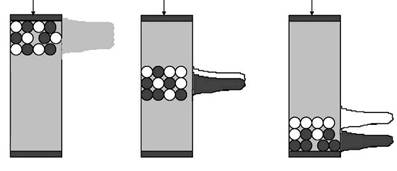
Переход молекул веществ из подвижной фазы в неподвижную и обратно за счет диффузии ничем не затруднен, тогда как внутри гранул диффузия затруднена из-за столкновений молекул диффундирующего вещества с нитями сетки полимера. В процессе хроматографии крупные молекулы не способны проникать внутрь гранул и элюируются с колонки с передним фронтом подвижной фазы - «фронтом элюции». Коэффициент распределения К для таких молекул равен нулю. Мелкие молекулы, легко диффундирующие внутрь гранул, свободно распределяются между подвижной и неподвижной фазами. Значение К для таких молекул близко к единице, и они элюируются с колонки позднее, чем крупные молекулы (рис. 5). Для молекул средних размеров не весь объем гранул может быть доступен, поэтому они будут перемещаться вдоль колонки с промежуточной скоростью: быстрее, чем мелкие молекулы, но медленнее, чем крупные (0<К<1). Таким образом, разделение молекул при гель-хроматографии будет происходить в зависимости от их размера (рис. 5), поэтому метод гель-хроматографии еще называют методом молекулярных сит или гель-фильтрацией. Хотя часто размеры молекул определяются их массами, при разделении белков методом гель-хроматографии нужно учитывать также форму их молекул, так как очевидно, что глобула будет проникать внутрь гранул иначе, чем вытянутая молекула.
аб
 Рис. 5. Разделение белков методом гель-хроматографии. а - На колонку наносят смесь веществ, молекулы которых имеют различный размер (или различную молекулярную массу). Крупные молекулы не могут проникнуть в гранулы и первыми элюируются с колонки, мелкие молекулы проникают в гранулы и задерживаются там (по [https://www.mikeblaber.org/oldwine/bch5425/lect31/lect31.htm] с изменениями; б - гранула сорбента в разрезе (по [https://www.ccbcweb.net/archive/Col_Chrom1.htm] с изменениями).
Рис. 5. Разделение белков методом гель-хроматографии. а - На колонку наносят смесь веществ, молекулы которых имеют различный размер (или различную молекулярную массу). Крупные молекулы не могут проникнуть в гранулы и первыми элюируются с колонки, мелкие молекулы проникают в гранулы и задерживаются там (по [https://www.mikeblaber.org/oldwine/bch5425/lect31/lect31.htm] с изменениями; б - гранула сорбента в разрезе (по [https://www.ccbcweb.net/archive/Col_Chrom1.htm] с изменениями).
Коэффициент распределения (К) (см. формулу 2) определенной хроматографической зоны при гель-хроматографии (в отсутствие сорбции молекул веществ, когда концентрация вещества в обеих фазах одинакова), можно представить отношением объемов подвижной и неподвижной фаз:
Vs
К = ¾¾, (6)
Vo
где Vs - суммарный объем жидкости неподвижной фазы
внутри гранул, доступный для молекул данного
размера
Vo - объем подвижной фазы - свободного объема
колонки вне гранул (рис. 6)
Долю внутреннего объема гранул, доступную для молекул данного размера, можно охарактеризовать неким коэффициентом Кd –«коэффициентом доступности». Тогда, если Vi - полный внутренний объем всех гранул, то
Vs = K•Vo= Kd •Vi (7)
Очевидно, что для очень мелких частиц Kd=1 и Vs=Vi. В других случаях его значения могут лежать в интервале 0£Kd£1. Величина Kd играет важную роль в характеристике процесса гель-хроматографии. Ее можно определить для каждой группы молекул определенного размера, элюируемых с колонки отдельным пиком.
Объем элюента, «вышедшего» из колонки к моменту появления пика вещества (Ve), будет определяться по формуле:
Ve = Vo + Vs = Vo + Kd •Vi (8)
Следовательно,
Ve - Vo
Kd = ¾¾¾¾¾ (9)
Vi
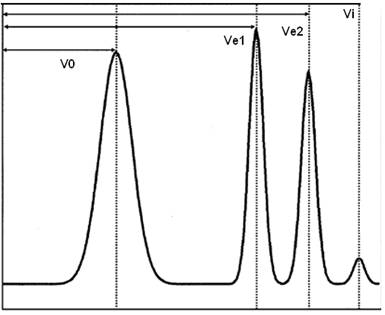
Таким образом, величину Kd легко найти экспериментально. Для этого определяют (рис. 6, 7): 1) Ve – объем элюента от момента нанесения образца до достижения максимума пика исследуемого вещества (или, если пик не острый, как объем от начала внесения препарата на колонку до того момента, когда концентрация элюируемого вещества на выходе с колонки достигнет 50% от своего максимального значения); 2) Vo - объем элюции очень крупных молекул (на практике для определения Vo часто используют окрашенное вещество с молекулярной массой 2×106 Да - «голубой декстран»). Эта величина называется «свободным объемом колонки» и определяет общий объем внешнего растворителя, находящегося вне гранул (o utsite); 3) Vi - объем элюции очень мелких частиц (например, ионов солей), для которых Kd=1. Эта величина характеризует объем растворителя внутри гранул геля (i nside).
Оптическое
Поглощение
Объем элюции (мл)
Рис. 6. Хроматограмма разделяемых на колонке соединений 1 и 2 с пиками их элюции. V0 – свободный объем колонки вне гранул, Ve1 и Ve2 – удерживаемый объем веществ 1 и 2, соответственно, Vi – объем элюции мелких частиц или объем внутри гранул геля. По оси ординат откладывают концентрацию разделяемых веществ по ходу хроматографии или величины, им пропорциональные, например, оптическое поглощение элюента (по [https://media.wiley.com/CurrentProtocols/ET/et0601-fig-0008-1-full.gif] с изменениями).
Однако, поскольку никогда нельзя полностью исключить возможность частичной сорбции мелких молекул внутри гранул, на практике нередко предпочитают использовать другой коэффициент - Kav (от англ. - available), характеризующий движение хроматографической зоны вдоль колонки при гель-фильтрации и определяемый как:
Ve - Vo
Kav = ¾¾¾¾, (10)
Vt - Vo
где Vt - общий (total) объем колонки (рис. 6) (его легко
определить как объем цилиндра или измерить,
заполнив колонку водой).
Vo Vt-Vo Vt
а
Высокая Средняя Низкая