ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
· Первые 4 алкана (с метана по бутан включительно) – газообразные вещества без цвета и запаха, именно поэтому в бытовой газ метан (который используют в газовых плитах в квартирах) добавляют пахучее вещество, чтобы хоть как-то можно было распознать утечку газа
· Начиная с С5Н12 по С15Н32 – бесцветные жидкости
· С С16 и далее – твердые вещества белого цвета жирные на ощупь
· Алканы не смешиваются с водой и не растворяются в ней, но растворимы в неполярных органических растворителях (помним правило, подобное растворяется в подобном)
· По мере увеличения числа атомов углерода в цепи, повышается температура плавления и кипения
· Алканы с разветвленной цепью кипят при более низких температурах, чем неразветвленные
· Начиная с пропана, алканы имеют зигзагообразную форму
· Только для алканов характерны конформации (химическое строение молекулы остается неизменным, просто фрагменты молекул вращаются вокруг σ-связей, при этом по сути ничего не меняется)
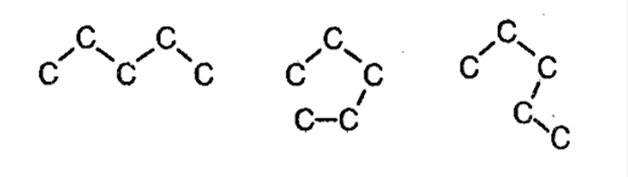
Один и тот-же н-пентан. Просто разные конформации. Но от этого он не перестает быть нормальным, неразветвленным пентаном
Ну и названия первых 10 алканов неплохо бы запомнить)

ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Для алканов характерны реакции замещения по радикальному механизму
1. Галогенирование
Реакция проводят только с хлором и бромом, не выпендриваемся и не пытаемся провести реакции с йодом и фтором
Со фтором реакция идёт слишком энергично (со взрывом) и просто не имеет практического применения, поэтому не используем его
С йодом реакция не идёт, он слишком слабый и не способен к реакции прямого замещения водорода
Обязательным условием реакции является облучение светом hν! Если не написать это условие – баллы с плеч полетят
CH4 + Cl2 → hν CH3-Cl + HCl
Хлорировать можно и дальше. Метан можно дохлорировать до тетрахлорметана.
Важно знать, что такое хлороформ – это трихлорметан
Суть реакции: атом галогена вытесняет один из атомов водорода и вытесненный атом водорода не исчезает в никуда, а уходит со вторым, брошенным атомом галогена
В первую очередь замещается водород при третичных, затем при вторичных и только потом уже при первичных атомах углерода. То есть отнимают всегда сначала там, где и так мало.
СН3-СН2-СН3 + Br2 → hν CH3-CHBr-CH3 + HBr
АЛКАНЫНЕ ОБЕСЦВЕЧИВАЮТ БРОМНУЮ ВОДУ И РАСТВОР ПЕРМАНГАНАТА КАЛИЯ
2.РЕАКЦИЯ НИТРОВАНИЯ (РЕАКЦИЯ КОНОВАЛОВА)
Не сильно отличается от галогенирования, только тут атом водорода в алкане замещается на нитрогруппу NO2 и образуется нитроалкан. Процесс нитрования протекает также по радикальному механизму.
Проводят реакцию разбавленной азотной кислотой (10%) при нагревании до 140°C
CH4 + HO-NO2 (разб) → t CH3NO2 + H2O

HNO3 расписала как HO-NO2 чисто для удобства и понимания процесса, можно писать просто HNO3(разб)
3. СУЛЬФИРОВАНИЕ АЛКАНОВ
Эта реакция встречается КРАЙНЕ редко, но встречается, поэтому считаю, что нужно про нее написать
Это замещение атома водорода на сульфогруппу SO3H c образованием алкансульфокислот. Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н записывают для удобства).
Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
СН4 + HO-SO3H(конц) → t CH3SO3H + H2O (сульфометан и вода)

4.ДЕГИДРИРОВАНИЕ.
Так как алканы – предельные углеводороды, то что-то прибавить к ним не получится. Но можно отнять водород. И такая реакция называется дегидрирование – отщепление водорода.
Протекает при температуре 300-350°C и при катализаторе Cr2O3 (также используют Ni)

5. ДЕГИДРОЦИКЛИЗАЦИЯ (АРОМАТИЗАЦИЯ)
Предельные у/в, содержащие 6 и более атомов углерода в цепи при нагревании в присутствии катализатора (Pt) способны к реакции дегидрирования с замыканием цикла
Из гексана получается бензол
Из гептана толуол и т.д
СН3-СН2-СН2-СН2-СН2-СН3 → t,Pt C6H6 + 4H2 (бензол + водород)
6.ИЗОМЕРИЗАЦИЯ
В результате реакции неразветвленный алкан превращается в свой разветвленный изомер с третичным атомом углерода
Катализатором реакции служит Al2O3 или AlCl3 и температура

7.КРЕКИНГ АЛКАНОВ
При нагревании в 450-600°C происходит разрыв углеродной цепи (примерно посередине) с образованием алкана с меньшим числом углеродов в цепи и алкена
СН3-СН2-СН2-СН3 (бутан) → 600°C СН3-СН3 (этан) + СН2=СН2 (этен, он же этилен)
8.ПИРОЛИЗ
При сильном нагревании выше 1000°C без доступа воздуха алканы разлагаются на С и Н
СН4 →1000°CС + 2Н2
При нагревании до 1500°C, а затем мгновенном охлаждении продуктов пиролиза метана образуется ацетилен
2СН4 →1500°CCH≡CH + 3Н2
9.КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ КИСЛОРОДОМ ВОЗДУХА
Гомологи метана окисляются при нагревании в присутствии соединений марганца с образования кислот.
Окислением бутана в промышленности получают уксусную кислоту
2СН3-СН2-СН2-СН3 +5О2 →MnO2,t4СН3-СOOH + 2H2O
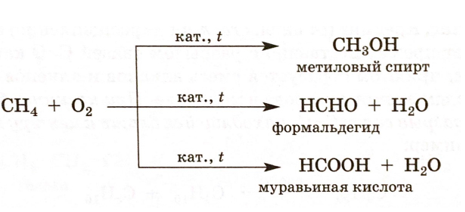
В зависимости от катализатора и условий проведения реакции при каталитическом окислении метана образуется или спирт, или альдегид, или кислота
10.ГОРЕНИЕ
Все углеводороды горят по одному сценарию
СН4+2О2 → t СО2 + 2Н2О
При недостатке кислорода у/в сгорает неполностью, в результате образуется ядовитый газ СО или выделяется углерод в свободном виде
2СН4 + 3О2(недостаток) → t 2СО + 4Н2О
СН4 + О2(недостаток) → t С + 2Н2О
11.КОНВЕРСИЯ МЕТАНА
В обычных условиях алканы не реагируют с водой и с углекислым газом. Процесс протекает при высокой температуре (800°C) и в присутствии никелевого катализатора. Только в этих условиях метан реагирует с CO2 и H2O.
Образуется смесь оксида углерода (2) и водорода, которую называют синтез-газом
СН4 + Н2О → t,NiCO + 3H2
CH4+ CO2 →800°C Ni2CO + 2H2
ПОЛУЧЕНИЕ МЕТАНА