Филграстим (Filgrastimum)
Русское название
Филграстим
Английское название
Filgrastim
Химическое название
N-L-Метионилколониестимулирующий фактор (человеческий генно-инженерный); негликозилированный протеин, состоящий из 175 аминокислот
Фармакологическая группа вещества Филграстим
Характеристика вещества Филграстим
Стимулятор лейкопоэза. Вырабатывается лабораторным штаммом бактерии Escherichia coli, в которую методами генной инженерии введен ген гранулоцитарного колониестимулирующего фактора человека.
Лейкостим (филграстим) - Первый российский гранулоцитарный колониестимулирующий фактор. Профилактика и лечение нейтропении, ассоциированной с химиотерапией и терапией ВИЧ.
Филграстим представляет собой одну полипептидную цепь, состоящую из 175 аминокислотных остатков и содержащую на N-конце не отщепленный метионин. Молекула филграстима, также как и природный Г-КСФ, содержит в положении 17 остаток цистеина со свободной сульфгидрильной группой и две внутримолекулярные дисулифидные связи в положениях Cys36—Cys42 и Cys64—Cys74. ДвеS-S-связи формируют две малые петли, разделенные 21 аминокислотным остатком. Подобно другим рекомбинантным белкам, которые продуцируются в клетках E.coli в виде телец включения, филграстиму необходимо пройти процедуру окислительного рефолдинга для восстановления своей биологической активности.
Химическая формула
C845H1343N223O243S9
Молярная масса
18802.8 г/моль
Стерильная бесцветная жидкость для парентерального введения. Молекулярная масса 18800 Да.
Филграстим - Filgrastim
Филграстим, продаваемый, среди прочего, под торговой маркой Neupogen, представляет собой лекарство, используемое для лечения низкого количества нейтрофилов. Низкое количество нейтрофилов может быть вызвано ВИЧ / СПИДом, после химиотерапии или радиационным отравлением либо по неизвестной причине. Его также можно использовать для увеличения количества лейкоцитов, которые собираются во время лейкафереза . Его вводят либо инъекцией в вену, либо под кожей.
Лейкаферез — удаление большого числа лейкоцитов из кровяного русла с помощью сепаратора клеток крови даже при повторных сеансах дает незначительный и нестойкий эффект.
Общие побочные эффекты включают жар, кашель, боль в груди, боль в суставах, рвоту и выпадение волос. Тяжелые побочные эффекты включают разрыв селезенки и аллергические реакции. Филграстим представляет собой форму рекомбинантной ДНК природного колониестимулирующего фактора гранулоцитов (G-CSF). Он действует, стимулируя организм к увеличению выработки нейтрофилов.
Нейтрофи́лы — наиболее многочисленная группа гранулоцитов, на долю которой приходится от 40 % до 70 % всех лейкоцитов у человека. Нейтрофилы являются частью врождённого иммунитета, их основная функция - фагоцитоз патогенных микроорганизмов (бактерий, грибков, простейших) и продуктов распада тканей организма.
Нейтрофилы представляют собой очень подвижные клетки, которые проникают даже в те ткани, которые недоступны для других лейкоцитов. В зависимости от морфологии ядра нейтрофилы подразделяют на палочкоядерные (незрелые) и сегментоядерные (зрелые) нейтрофилы. Развитие нейтрофилов находится под контролем цитокинов, прежде всего G-CSF, а также GM-CSF, IL-3 и IL-6. В условиях воспалительного ответа количество нейтрофилов увеличивается под действием IL-17 и IL-23.
Филграстим был одобрен для медицинского применения в США в 1991 году. Он включен в Список основных лекарственных средств Всемирной организации здравоохранения. Филграстим биоподобные препараты доступны.
Филграстим используется для лечения нейтропении, стимулируя костный мозг для увеличения выработки нейтрофилов. Причины нейтропении включают химиотерапию и трансплантацию костного мозга.
Филграстим также используется для увеличения количества гемопоэтических стволовых клеток в крови перед забором с помощью лейкафереза для использования при трансплантации гемопоэтических стволовых клеток.
Побочные эффекты
Наиболее часто наблюдаемыми побочными эффектами являются легкая боль в костях после повторного введения и местные кожные реакции в месте инъекции. Другие наблюдаемые побочные эффекты включают серьезные аллергические реакции (включая сыпь по всему телу, одышку, головокружение, отек вокруг рта или глаз, учащенный пульс и потливость), разрыв селезенки (иногда в результате в случае смерти), альвеолярное кровоизлияние, острый респираторный дистресс-синдром и кровохарканье. Тяжелые серповидно-клеточные кризы, в некоторых случаях приводящие к смерти, были связаны с применением филграстима у пациентов с серповидно-клеточными заболеваниями.
Механизм действия
Филграстим представляет собой фактор, стимулирующий колонии гранулоцитов человека (G-CSF), полученный с помощью технологии рекомбинантной ДНК. G-CSF регулирует выработку нейтрофилов в костном мозге; эндогенный G-CSF представляет собой гликопротеин, продуцируемый моноцитами, фибробластами и эндотелиальными клетками.
G-CSF представляет собой колониестимулирующий фактор, который, как было показано, оказывает минимальное прямое воздействие in vivo или in vitro на продукцию других типы гемопоэтических клеток. Нейпоген (филграстим) - это название рекомбинантного метионилового фактора, стимулирующего колонии гранулоцитов человека (r-metHuG-CSF).
Способ применения и дозы: Подкожно (предпочтительнее) или внутривенно (инфузия) 1 раз в сутки. Выбор пути введения зависит от конкретной клинической ситуации. Дозы устанавливают индивидуально в зависимости от показаний, тяжести процесса, чувствительности больного. Лечение начинают не ранее чем через 24 ч после химиотерапии. Цитотоксически индуцированная нейтропения - обычно 0,5 млн ЕД/кг в сутки; миелоаблативная терапия с пересадкой костного мозга - 1 млн ЕД/кг в сутки; мобилизация клеток-предшественников гемопоэза - 1 млн ЕД/кг в сутки в течение 6 дней; тяжелая хроническая и врожденная нейтропения - начальная доза 1,2 млн ЕД/кг в сутки; злокачественная или периодическая нейтропения - начальная доза 0,5 млн ЕД/кг в сутки. Лечение продолжают до восстановления нормального содержания нейтрофилов (обычно до 14 дней). После индукционной и консолидационной терапии острого миелолейкоза продолжительность терапии может увеличиваться до 38 суток.
Коммерциализация
Филграстим продается под несколькими торговыми марками, в том числе:
Apricus Biosciences в настоящее время разрабатывает и тестирует продукт под торговой маркой Nupen, который может доставлять филграстим через кожу в улучшить восстановление количества нейтрофилов после химиотерапии.
Биосимиляры
В 2015 году filgrastim-sndz компании Sandoz (торговое название Zarxio) получил одобрение Управления по контролю за продуктами и лекарствами США (FDA) как биоаналог. Это был первый продукт, принятый в соответствии с Законом о ценовой конкуренции и инновациях в биопрепаратах от 2009 года (Закон BPCI) как часть Закона о доступном медицинском обслуживании. FDA отмечает, что Zarxio был одобрен как биоаналог, а не как взаимозаменяемый продукт. И согласно Закону BPCI, только биологический препарат, который был одобрен как «взаимозаменяемый», может быть заменен эталонным продуктом без вмешательства поставщика медицинских услуг, прописавшего эталонный продукт. FDA заявило, что одобрение Zarxio основано на обзоре доказательств, включающих структурную и функциональную характеристику, данные исследований на животных, данные фармакокинетики и фармакодинамики человека, данные клинической иммуногенности и другие данные о клинической безопасности и эффективности, которые демонстрируют, что Zarxio является биоподобен нейпогену.
Zarxio одобрен для применения по тем же показаниям, что и нейпоген, и может быть назначен медицинским работником: больным раком, получающим миелосупрессивную химиотерапию; пациенты с острым миелоидным лейкозом, получающие индукционную или консолидирующую химиотерапию; больные раком, перенесшие трансплантацию костного мозга; пациенты, проходящие забор и терапию аутологичных клеток-предшественников периферической крови; и пациенты с тяжелой хронической нейтропенией.
Neukine - это индийский биосимлар. Филграстим и одобрен по тем же показаниям, что и Нейпоген. Neukine производится и продается компанией Intas Pharmaceuticals Limited в Ахмедабаде, Индия.
В сентябре 2008 г. в Европейском Союзе были одобрены для использования ратиограстим, Филграстим, биограстим и филграстим ратиофарм. Филграстим ратиофарм был отозван в июле 2011 года, а Биограстим - в декабре 2016 года.
В феврале 2009 года Филграстим Гексал и Зарцио были одобрены для использования в Европейском Союзе.
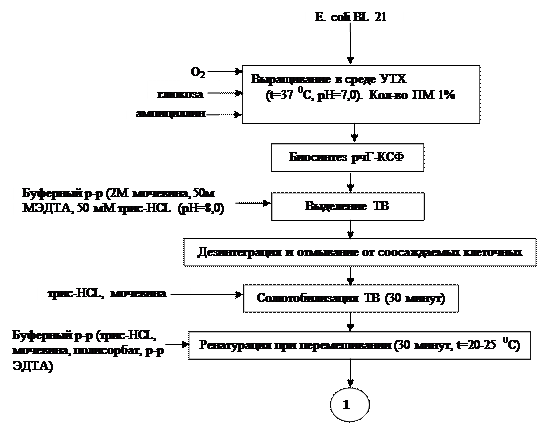
Эскизная схема производства
Биосинтез рчГ-КСФ ( Гранулоцитарный колониестимулирующий фактор человеческий рекомбинантный) клетками продуцента E.coli BL21 (DE3)/pES3-7. Культуру полученного ранее штамма выращивают в 250 л питательной среде УТХ2 содержащей глюкозу в концентрации 6 г/л и ампициллин в концентрации 100 мкг/л в ферментере, объемом 400 л (Electrolux, Швеция) при температуре 37° и рН 7,0. Количество посевного материала составляло 1% от объема питательной среды. Значение рН во время процесса корректировали путем подачи 25% -ого раствора NH4OH. Содержание растворенного кислорода поддерживали на уровне 20% от максимального насыщения путем увеличения скорости перемешивания КЖ от 250 до 400 об/мин и расхода воздуха от 150 до 250 л/ч. Через 3 ч культивирования добавляли ИПТГ до концентрации 0,25 мМ и продолжали процесс еще 2,5—3 ч. Затем клетки, содержащие ТВ, отделяли центрифугированием КЖ на проточной центрифуге (CEPA61 G, Германия) при 16000 об/мин и скорости подачи КЖ в ротор центрифуги 3—4 л/мин (по ротаметру).
Выделение ТВ. Клетки, содержащие ТВ, суспендировали в буферном растворе, содержащем 2М мочевину, 50м МЭДТА, 50 мМ трис-HCl, рН 8,0, в соотношении 1:10 (масса: объем) и разрушали в проточном дезинтеграторе (Gaulin, Германия) при давлении 600 бар. После дезинтеграции клеточную суспензию центрифугировали на проточной центрифуге (CEPA61G,Германия) при 16000 об/мин и скорости подачи суспензии в ротор центрифуги 1л/мин (по ротаметру). ТВ дважды отмывали от соосождаемых клеточных компонентов в буферном растворе, содержащем 50 мМ трис-HCl, рН 8,0. Соотношение осадок ТВ: буфер в процессе отмывок составляло 1:10 (масса:объем).Отмытые ТВ выделяли из суспензии центрифугированием, как описано выше. Содержание рекомбинантного белка в суммарном клеточном лизате и чистоту ТВ анализировали с помощью ЭФПААГ по методу Лэммли.
Солюбилизация ТВ. 280 г влажных ТВ растворяли в 8 л буферного раствора, содержащего 50 мМ трис-HCl, 2М мочевину, рН 11.0, и оставляли перемешиваться в течение 30 мин при комнатной температуре.
Ренатурация. Раствор белка, полученный после солюбилизации, добавляли к различному количеству буферного раствора, содержащего 5 мМ трис-HCl и 0,1 % полисорбата 20, рН 8,0. рН раствора доводили до значения 8,01 М раствором уксусной кислоты. Затем полученный раствор медленно добавляли к 3,0 мл 1 М раствора сульфата меди реакционную смесь оставляли при комнатной температуре и перемешивании на 16—18 ч. В раствор вносили 800 мл 0,5 М раствора ЭДТА и оставляли еще на 2 ч. рН смеси медленно доводили до 4,01 М раствором уксусной кислоты.
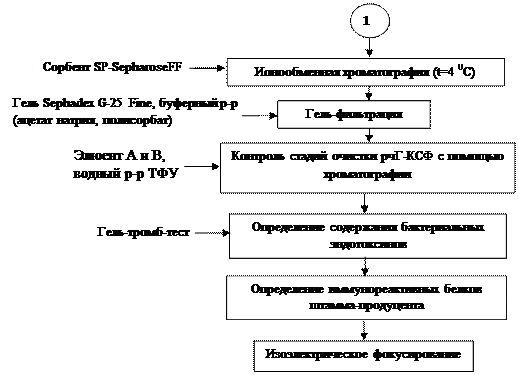
Ионообменная хроматография. Хроматографическую очистку рчГ-КСФ проводили при температуре 4° на радиальной колонке объемом 1л. В качестве сорбента использовали SP-SepharoseFF. Раствор белка после ренатурации (82 л) с помощью перистальтического насоса (Masterflex, США) соскоростью 300 мл/мин наносили на радиальную колонку Sepragen 1000, уравновешенную 50 мМ натрий-ацетатным буферным раствором, рН 4,0 (стартовый буфер). После нанесения всего объема белка сорбент промывали тремя объемами стартового буфера. Сорбированный белок элюировали градиентом концентрации хлорида натрия от 0 до 0,5 М в том же буферном растворе. Белок отбирали в соответствии с фотометрическим профилем при длине волны 280нм; фракции, содержащие филграстим, объединяли; присутствие целевого белка определяли с использованием ОФ-ВЭЖХ.
Гель-фильтрация. Раствор белка после ионообменной хроматографии наносили на колонку BPG (200-500мм) (Amersham-Bioscience, США), заполненную гелем Sephadex G-25Fine. Колонку предварительно уравновешивали буферным раствором, содержащим 20 мМ ацетат натрия, 5% сорбита и 0,004 % полисорбата 80, рН 4,0. Тот же буферный раствор использовали для проведения элюции белка при скорости потока 120 мл/мин. Белок в элюате детектировали с помощью проточного фотометра (Knauer K-2501, Германия) при длине волны280нм.
Контроль стадий очистки рчГ-КСФ и определение концентрации. Хроматографию проводили в обращенно-фазовом режиме на колонке Symmetry 300 C4 (Waters, США) в буферной системе, которая состояла из элюента А, содержащего 0,1 %-ный водный раствор ТФУ, и элюента В, содержащего 20 % ацетонитрил в 1 –пропаноле с 0,1% ТФУ. Линейный градиент задавали от 40 до 50 % по раствору В, скорость потока составляла 1 мл/мин, температура —35°, детекцию осуществляли при длине волны 210 нм. Для сравнения использовали препарат Нейпоген.
Определение содержания бактериальных эндотоксинов. Пирогенность Г-КСФ определяли с помощью гель-тромб-теста с реактивами фирмы Charles River Endosafe, США: ЛАЛ-реактив Endosafe с заявленной чувствительностью, равной 0,03 ЕЭ/мл при концентрации КСЭ 10 нг/мл. Согласно инструкции фирмы-изготовителя, допустимые значения рН испытываемого образца составляют 6,0—8,0. Чтобы исключить влияние низкого рН препарата наг елеобразование, анализируемый образец разводили в буферном растворе, содержащем 50 мМ трис-HCl, рН7,5. Предельное содержание бактериальных эндотоксинов не должно превышать значение 6 ЕЭ на1мг рчГ-КСФ.
Определение иммунореактивных белков штамма-продуцента. Примеси остаточных белков штамма-продуцента определяли с помощью твердофазного иммуноферментного анализа. Для этого использовали набор Immunoenzymetric Assayforthe Measurementof Е.coli Host Cell Proteins, кат. №F010 фирмы Cygnus Technologies, Inc, США.
Изоэлектрическое фокусирование. Примеси и изоформы рчГ-КСФ обнаруживали методом изоэлектрического фокусирования на приборе “MultiphorII“ фирмы Amersham-Bioscience, используя пластины Ampholine PAG, pH 4,0—6,5. Пробы наносили в количестве 20 мкл. Окраску геля проводили кумасси R-250 (Sigma, США).
Риск, связанный с высокодозной химиотерапией
Особую осторожность следует проявлять при лечении пациентов, получающих высокодозную химиотерапию, поскольку повышенные дозы химиопрепаратов обладают более выраженной токсичностью, включая кожные реакции и побочные эффекты со стороны сердечно-сосудистой, нервной и дыхательной систем (см. инструкции к применению конкретных химиопрепаратов).
Монотерапия филграстимом не предотвращает развитие тромбоцитопении и анемии, обусловленных миелосупрессивной химиотерапией. Из-за возможности применения более высоких доз химиопрепаратов (например, полные дозы в соответствии со схемами), пациент может подвергаться большему риску развития тромбоцитопении и анемии. Рекомендуется регулярно дважды в неделю проводить анализ крови, определять количество тромбоцитов и гематокрит в процессе применения филграстима после химиотерапии. Особую осторожность следует проявлять при применении однокомпонентных или комбинированных химиотерапевтических схем, способных вызывать тяжелую тромбоцитопению.
При применении филграстима для мобилизации было выявлено уменьшение степени тяжести и продолжительности тромбоцитопении, обусловленной миелосупрессивной или миелобластической химиотерапией.
Меры предосторожности для пациентов с ВИЧ-инфекцией
Количество клеток крови
Необходимо строго контролировать АКН, особенно в течение первых недель терапии препаратом Филграстим. У некоторых пациентов может отмечаться очень быстрое и значительное увеличение АКН при начальной дозе препарата Филграстим. В течение первых 2-3 дней применения препарата рекомендуется ежедневно измерять АКН. Впоследствии АКН следует проверять минимум 2 раза в неделю в течение первых 2 недель и затем каждую неделю или через неделю на протяжении всего курса поддерживающей терапии. При перерыве в применении препарата Филграстим в дозе 30 млн. МЕ/сут (300 мкг/сут) у пациента во время лечения могут наблюдаться значительные колебания АКН. С целью определения минимального АКН (надира) рекомендуется проводить контроль общего анализа крови перед каждым введением препарата Филграстим.
Риск, обусловленный применением высоких доз миелосупрессивных лекарственных препаратов (МСЛП)
Монотерапия препаратом Филграстим не применяется для предотвращения развития тромбоцитопении и анемии на фоне применения МСЛП. В случае применения более высоких доз или одновременно нескольких МСЛП в сочетании с терапией препаратом Филграстим, риск развития тромбоцитопении и анемии повышается. Рекомендуется регулярный контроль с использованием развернутого анализа крови.
Развитие миелосупрессии вследствие инфекций или опухолевых новообразований
Нейтропения может быть обусловлена поражением костного мозга при оппортунистических инфекциях, которые вызываются такими возбудителями, как Mycobacterium avium complex, или злокачественными новообразованиями, например, лимфомой. При выявлении инфильтративного поражения костного мозга, воспалительного поражения или злокачественного новообразования, одновременно с применением препарата Филграстим для лечения нейтропении необходимо применение соответствующей терапии диагностированных заболеваний. Эффективность применения препарата Филграстим при лечении нейтропении, обусловленной поражением костного мозга инфекционного генеза или опухолевыми новообразованиями, не установлена.
Эскизная схема производства Филграстима
 | |||
 |