ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«СЕВЕРО-ОСЕТИНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ»
Министерства здравоохранения Российской Федерации
(ФГБОУ ВО СОГМА Минздрава России)
КЛИНИКО-ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ОПРЕДЕЛЕНИЯ БЕЛКОВОГО СПЕКТРА ПЛАЗМЫКРОВИ.
ВИДЫПРОТЕИНОГРАММ.
ФЕРМЕНТЫПЛАЗМЫКРОВИ
(клинико-диагностическое значение)
Белки — это высокомолекулярные азотсодержащие органические соединения, в состав которых входят более 20 видов аминокислот. Простые белки состоят только из аминокислот, сложные белки (липопротеиды, гликопротеиды, нуклеопротеиды, хромопротеиды и др.) помимо аминокислот содержат различные небелковые компоненты: липиды, углеводы, нуклеиновые основания, хромогены и другие вещества.
Белки занимают центральное место в метаболизме организма человека, выполняя ряд важных функций:
1) структурную (структурная основа клеток, органеллы, фибриллярные белки);
2) транспортную (липопротеиды, гемоглобин, альбумин);
3) сократительную (мышечные белки — актин, миозин);
4) каталитическую (ферменты);
5) регуляторную (гормоны);
6) защитную(иммуноглобулины, антитела, интерферон; белки системы свертывания крови и фибринолиза);
7) энергетическую (распад аминокислот обеспечивает до 18% потребляемой энергии).
Белковый обмен представляет собой чрезвычайно сложный процесс, обеспечивающий у взрослого здорового человека динамическое равновесие между биосинтезом (анаболизмом) белков, протекающим с использованием энергии, и распадом (катаболизмом) белков, сопровождающимся выделением энергии.
Нормальная интенсивность биосинтеза белка в тканях и органах, соответствующая потребностям организма, определяется действием нескольких факторов:
1. Достаточным поступлением в организм пищевого белка (не менее 100 г/с), содержащего необходимое количество незаменимых аминокислот.
2. Полноценным перевариванием белков в органах желудочно-кишечного тракта, что обеспечивается, прежде всего, ферментами желудка (пепсином, гастриксином), поджелудочной железы (трипсином, химотрипсином, карбоксипептидазой А и В, эластазой) и тонкого кишечника (энтеропептидазой).
3. Всасыванием продуктов гидролиза белков (аминокислот) в тонком кишечнике, что предъявляет серьезные требования к состоянию слизистой оболочки тонкой кишки, ее моторике и наличию соответствующих транспортных белков — переносчиков аминокислот.
4. Адекватным энергетическим обеспечением (АТФ, ГТФ) биосинтеза белков во всех тканях и органах (прежде всего — в печени) и его регуляцией анаболическими гормонами (половые гормоны, инсулин, СТГ гипофиза) и витаминами (С, В6 и др.).
Нарушение действия любого из перечисленных факторов может привести к угнетению биосинтеза белков в организме и развитию белковой недостаточности.
Концентрация белков в плазме здорового человека колеблется от 65 до 85 г/л. Основная часть общего белка плазмы крови (около 90%) приходится на альбумины, глобулины и фибриноген.
Альбумины — это наиболее гомогенная фракция простых белков, почти исключительно синтезирующихся в печени. Около 40% альбуминов находится в плазме, а 60% — в межклеточной жидкости. Основные функции альбуминов — поддержание коллоидно-осмотического (онкотического) давления, а также участие в транспорте многих эндогенных и экзогенных веществ (свободных жирных кислот, билирубина, стероидных гормонов, ионов магния, кальция, антибиотиков, сердечных гликозидов, барбитуратов, ацетилсалициловой кислоты и др.).
Глобулины сыворотки крови представлены четырьмя фракциями (α1, α2, β и γ), каждая из которых не является однородной и содержит несколько белков, отличающихся по своим функциям.
В состав α1- глобулинов в норме входят два белка, имеющих наибольшее клинической значение:
1. α1-антитрипсин, являющийся ингибитором ряда протеаз (трипсина, химотрипсина, калликреина, плазмина);
2. α1-гликопротеид, участвующий в транспорте прогестерона и тестостерона и связывающий небольшие количества этих гормонов.
1. α2-макроглобулин — ингибитор ряда протеолитических ферментов (трипсина, химотрипсина, тромбина, плазмина, калликреина), синтезируется вне печени;
2. гаптоглобин — белок, связывающий и транспортирующий свободный гемоглобин А в клетки ретикулоэдотелиальной системы;
3. церулоплазмин — обладает оксидазной активностью и окисляет двухвалентное железо в трехвалентное, что обеспечивает его транспорт трансферрином;
4. апопротеиды А, В и С, входящие в состав липопротеидов.
Фракция β -глобулинов также содержит несколько белков:
1. трансферрин — белок, участвующий в транспорте трехвалентного железа;
2. гемопексин — переносчик свободного гема и порфирина, связывает геминсодержащие хромопротеиды (гемоглобин, миоглобин, каталазу) и доставляет их в клетки РЭС печени;
3. липопротеиды;
4. часть иммуноглобулинов;
5. некоторые белковые компоненты комплемента.
γ-глобулины — это иммуноглобулины, которым свойственна функция антител, вырабатываемых в организме в ответ на внедрение различных веществ, обладающих антигенной активностью; современные методы позволяют выделить несколько классов иммуноглобулинов (IgG, IgA, IgM, IgD и IgE).
Фибриноген является важнейшим компонентом системы свертывания крови (фактор I). Он образует основу кровяного сгустка в виде трехмерной сети, в которой задерживаются клетки крови.
Методы исследования
Стандартный набор биохимических показателей, отражающий состояние белкового обмена, чаще ограничивается определением содержания общего белка, белковых фракций (альбумина, α1-, α2-, β- и γ-глобулинов) и фибриногена. При необходимости определяют также С-реактивный белок (CRP), содержание серомукоида и других белков сыворотки крови.
Общий белок. Наиболее распространенным методом определения общего белка сыворотки крови является так называемый биуретовый метод. В состав биуретового реактива входит сульфат меди, который в щелочной среде реагирует с белками сыворотки и образует соединения, окрашенные в фиолетовый цвет. Интенсивность окраски, зависящую от концентрации белка в сыворотке, определяют на фотометре и сопоставляют с интенсивностью калибровочного раствора с известной концентрацией альбумина (фотометрический метод).
Существует также рефрактометрический способ определения общего белка, основанный на принципе измерения показателей преломления света, проходящего через окрашенные соединения.
Альбумин. Количество альбумина в сыворотке крови определяют фотометрическим методом с использованием красителя бромкрезолового зеленого, который при взаимодействии с альбумином в слабокислой среде образует окрашенный комплекс синего цвета.
.
Белковые фракции. В клинической практике для определения различных фракций белка (в том числе альбуминов, α1-, α2-, β- и γ-глобулинов) чаще используют метод электрофореза. Скорость движения отдельных белковых фракций по направлению к аноду (+) зависит от их электрического заряда и других физико-химических свойств. Наиболее быстро движется к аноду фракция альбумина, затем α1-, α2-, β- и γ-глобулинов. После окончания электрофоретического разделения белковых фракций пленки из ацетата или полоски бумаги высушивают на воздухе и в сушильном шкафу и окрашивают одним из красителей (бромфеноловым синим, пунцовым С и др.).
Таким образом получают кусочки бумажной ленты или пленки из ацетата целлюлозы, содержащие отдельные белковые фракции — электрофореграммы. Интенсивность окраски, соответствующую концентрации отдельных белковых фракций, измеряют на фотометре или денситометре. Результаты выражают в процентах к содержанию общего белка сыворотки крови. Для наглядности строят графики количественного соотношения белковых фракций.
Для разделения белков сыворотки крови используют также другие, более тонкие методы исследования (ультрацентрифугирование, иммуноэлектрофорез и т. д.), позволяющие выявлять отдельные белки сыворотки, входящие в состав той или иной белковой фракции, а также определять их физико-химические свойства.
Интерпретация результатов
Содержание общего белка сыворотки крови у здорового человека колеблется в пределах от 65 до 85 г/л, а альбумина — от 35 до 50 г/л. Нормальные величины белковых фракций, выраженные в процентах по отношению к содержанию общего белка. здорового человека наблюдаются колебания этих величин в достаточно широких пределах, что отчасти обусловлено методом определения белковых фракций, в частности, видом красителя, используемого для окрашивания бумаги или пленок из ацетата целлюлозы с электрофореграммами.
Имеет значение также расчет альбуминово-глобулинового коэффициента (А/Г), который в норме равен примерно 1,5.
В табл. 1.4 представлены основные причины гипо- и гиперпротеинемии, а также некоторые механизмы нарушения содержания белка в сыворотке крови.
Таблица 1.4
Основные причины изменений содержания общего белка и альбумина в сыворотке крови 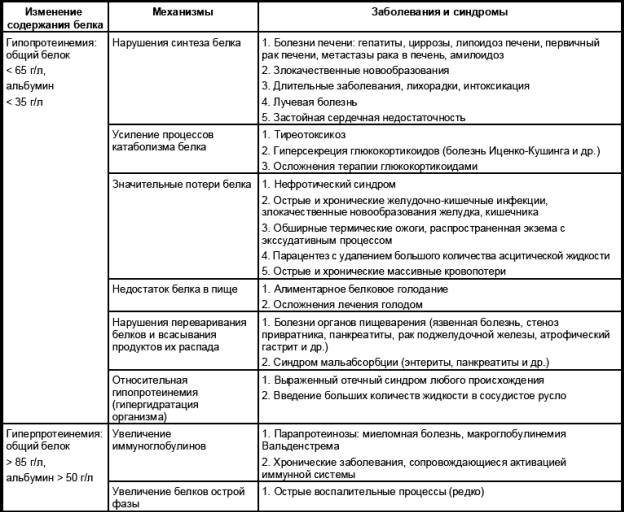
Следует иметь в виду, что при многих патологических состояниях в основе этих нарушений лежит сочетание сразу нескольких механизмов. Например, при злокачественных новообразованиях желудочно-кишечного тракта в основе гипопротеинемии может лежать не только угнетение синтеза белка на уровне клеток, обусловленное раковой интоксикацией, снижением активности анаболических гормонов, недостатком витаминов и нарушением функции печени при ее метастатическом поражении, но и недостаточное поступление белка с пищей вследствие характерной для этих заболеваний анорексии, нарушение переваривания и всасывания пищевых белков в желудочно-кишечном тракте, увеличение катаболизма белков и потеря их через желудочно-кишечный тракт.
Любые причины, приводящие к белковой недостаточности (например белковое голодание), закономерно вызывают усиление катаболизма собственных белков при их распаде, что сказывается на функции всех органов и систем.
Наиболее важными клиническими следствиями гипопротеинемии любого происхождения являются: 1) похудание, вплоть до кахексии, 2) анемия, 3) гипопротеинемические отеки (при снижении альбумина ниже 20 г/л), 4) нарушение функции различных органов и систем.
В табл. 1.5 представлены основные причины изменения содержания фракций глобулинов и белки этих фракций, ответственные за нарушения.
Таблица 1.5 
Наиболее частые причины изменения фракций глобулинов в сыворотке крови
Из таблицы видно, что увеличение содержания α 1- и α 2 -фракций глобулинов наблюдается при нескольких патологических состояниях:
1. При острых воспалительных процессах, поскольку в состав α-глобулинов входят так называемые белки острой фазы (α1-антитрипсин, α1-гликопротеид, α2-макроглобулин, гаптоглобулин, церулоплазмин, серомукоид, С-реактивный белок).
2. При значительном повреждении и распаде тканей (дистрофические, некротические процессы), сопровождающемся деструкцией клеток и высвобождением тканевых протеаз, калликреина, тромбина, плазмина и т. д., что закономерно приводит к увеличению содержания их естественных ингибиторов (α1-антитрипсина, α1-гликопротеида, α2-макроглобулина и др.). Повреждение тканей приводит также к высвобождению патологического С-реактивного белка, являющегося продуктом распада клеток и входящего в состав α1-фракции глобулинов. Значительная деструкция тканей наблюдается при злокачественных новообразованиях, метастазировании опухолей, тяжелых травмах, после оперативных вмешательств, при инфарктах различных органов (ишемический инсульт, инфаркт легкого, кишечника и др.).
3. При заболеваниях, сопровождающихся деполимеризацией гликопротеидов основного вещества соединительной ткани (коллагенозах), преимущественно за счет увеличения содержания гаптоглобулина и других белков.
4. При нефротическом синдроме, в частности за счет увеличения α2-макроглобулина.
5. Во время беременности — преимущественно за счет стимулирующего действия эстрогенов на синтез церулоплазмина, входящего в состав фракции α2-глобулинов.
Уменьшение содержания α-глобулинов в клинической практике встречается достаточно редко. Иногда оно наблюдается:
1. При тяжелых деструктивных процессах в паренхиме печени: при остром инфекционном гепатите, гепатолентикулярной дегенерации печени (болезни Вильсона-Коновалова), синдроме гепатоцеребральной дегенерации (болезни Вестфаль-Штрумпфель-Вильсона), при циррозах и раке печени, хроническом активном гепатите. В этих случаях уменьшение содержания α-глобулинов связывают со снижением синтеза гаптоглобулина, церулоплазмина, α1-гликопротеида.
2. При гемолизе эритроцитов, гемоглобинуриях, что объясняется усилением процесса связывания гаптоглобулина свободным гемоглобином.
3. При врожденном дефиците α 1- антитрипсина, входящего в состав α 1-фракции глобулинов и являющегося ингибитором тканевых протеаз, в том числе эластазы, разрушающей эластические волокна. Дефицит α1-антитрипсина может приводить к повреждению легочной ткани и развитию первичной диффузной деструктивной эмфиземы легких.
4. При снижении содержания α2 -макроглобулина — ингибитора некоторых протеолитических ферментов поджелудочной железы (трипсина, химотрипсина). Считают, что в некоторых случаях (редко) дефицит α 2-макроглобулина может способствовать поражению поджелудочной железы (панкреатит, сахарный диабет).
Увеличение фракции β-глобулинов наблюдается:
11. При первичных и вторичных гиперлипопротеидемиях, особенно II типа (подробнее — см. ниже), поскольку большая часть сложных белков липопротеидов входит в состав β-фракции глобулинов. Вторичные гиперлипопротеидемии чаще встречаются при атеросклерозе, сахарном диабете, гипотиреозе, нефротическом синдроме.
2. При длительных хронических заболеваниях, сопровождающихся увеличением содержания в крови иммуноглобулинов (обычно одновременно с увеличением содержания γ-глобулинов): хронических инфекциях, циррозе печени, болезнях соединительной ткани (ревматизм, РА, СКВ и др.), злокачественных новообразованиях, аутоиммунных и аллергических заболеваниях.
Уменьшение фракции β-глобулинов встречается редко:
1. При абеталипопротеидемии.
2. При атрансферринемии — редком заболевании, обусловленном дефицитом основного транспортного белка — трансферрина, что приводит к развитию железодефицитной анемии и вызывает картину гемосидероза (отложения железа во внутренних органах) с развитием гепатоспленомегалии.
Увеличение фракции γ-глобулинов обнаруживают при следующих патологических состояниях:
1. При заболеваниях, сопровождающихся интенсификацией иммунных процессов, поскольку фракция γ-глобулинов состоит главным образом из иммуноглобулинов: при хронических инфекциях, хронических заболеваниях печени (хронический гепатит и циррозы печени), аутоиммунных заболеваниях (в том числе заболеваниях соединительной ткани — РА, СКВ и др.), хронических аллергических заболеваниях (бронхиальная астма, рецидивирующая крапивница, лекарственная болезнь, атопический дерматит, экзема и др.).
2. При парапротеинемиях — заболеваниях, сопровождающихся образованием патологических белков (парапротеинов), относящихся к одному из классов иммуноглобулинов (G, А, реже D и Е): миеломной болезни (плазмоцитоме), макроглобулинемии Вальденстрема, болезни тяжелых цепей и др
.
Уменьшение фракции γ-глобулинов встречается:
1. При длительных хронических заболеваниях, сопровождающихся истощением иммунной системы и снижением образования иммуноглобулинов (хронических инфекциях, злокачественных новообразованиях, заболеваниях почек, печени, лимфолейкозе, лимфогранулематозе и др.).
2. При лечении цитостатиками, иммунодепрессантами, глюкокортикоидами, а также в результате рентгеновского облучения, применения радионуклидов или лучевой терапии.
3. При разнообразных иммунодефицитных состояниях, связанных с поражением В- и Т-лимфоцитов (агаммаглобулинемия Брутона, атаксия-телеангиоэктазия — синдром Луи-Бар и др.).
4. При избыточной потере белка (энтериты, нефротический синдром, обширные ожоги).
Приведенные данные свидетельствуют о том, что в каждом конкретном случае интерпретация протеинограммы чрезвычайно сложна и должна учитывать не только возможный нозологический диагноз, но и индивидуальные особенности клинической картины заболевания, его длительность, эффективность лечения, факт приема некоторых лекарственных препаратов, применения лучевой терапии,
состояние иммунной системы, наличие сопутствующих заболеваний и т. п. Тем не менее в большинстве случаев практический врач должен ориентироваться на следующие принципиальные положения:
1. Наиболее частыми причинами увеличениясодержания α-глобулинов являются острые воспалительные заболевания и заболевания, сопровождающиеся значительным повреждением и распадом тканей. 2. Увеличение β-глобулинов (особенно при сочетании с гипергаммаглобулинемией) чаще свидетельствует об активации иммунной системы организма у больных с разнообразными острыми или хроническими заболеваниями внутренних органов, хотя необходимо также учитывать возможность влияния гиперлипопротеидемии, особенно у больных с атеросклерозом, сахарным диабетом, гипотиреозом и нефротическим синдромом. 3. Увеличение содержания γ-глобулинов может быть также обусловлено значительной активацией иммунной системы или так называемыми парапротеинемиями (миеломной болезнью или макроглобулинемией Вальденстрема). 4. Уменьшение α-глобулинов чаще может быть связано с тяжелыми деструктивными процессами в печени, протекающими с нарушениями синтеза белка. 5. Гипогаммаглобулинемия свидетельствует о наличии иммунодефицитного состояния, вызванного истощением иммунной системы организма при длительных хронических заболеваниях, длительном лечении цитостатиками, иммунодепрессантами, глюкокортикоидами и лучевыми воздействиями. 6. Избыточная потеря белка организмом (энтериты, массивные ожоги, нефротический синдром), помимо гипоальбуминемии, может сопровождаться уменьшением содержания γ-глобулинов.
Методы определения в сыворотке крови фибриногена, серомукоида, С-реактивного белка и белковых осадочных проб, а также их диагностическое значение описаны в других разделах настоящего руководства.
Ферменты
Ферменты — это вещества белковой природы, которые обеспечивают нормальное протекание всех химических реакций в организме. Они отличаются высокой специфичностью по отношению к тем субстратам, на которые действуют, что объясняется их белковой природой и уникальной трехмерной пространственной организацией молекулы белка. Геометрическая форма активного центра ферментов, т. е. той части белковой молекулы, которая непосредственно взаимодействует с субстратом, должна полностью соответствовать форме молекулы субстрата. Вот почему малейшие нарушения вторичной или
третичной структуры молекулы фермента приводят к значительному снижению его активности.
На активность фермента влияют также другие факторы: 1) наличие температурного оптимума; 2) рН среды, ее ионный состав; 3) концентрация реагирующих субстратов; 4) действие на ферменты особых веществ — эффекторов ферментов (ингибиторов или активаторов), а также наличие в составе активного центра некоторых ферментов кофакторов — небелковых частей фермента (витаминов, нуклеотидов, ионов металлов), которые также необходимы для проявления активности ферментов.
Изменения активности ферментов в одних случаях можно рассматривать как следствие, в других — как причину различных патологических состояний.
Основными факторами, определяющими активность ферментов сыворотки крови, являются: 1) скорость синтеза ферментов в клетке; 2) скорость высвобождения ферментов из клетки, которая может увеличиваться, например, при повышении проницаемости и повреждении клеточной мембраны, обусловленных воспалением, ишемией, дистрофией, некрозом, аутоиммунными повреждениями клеток и т. п.; 3) скорость удаления ферментов из внеклеточной жидкости путем их инактивации, разрушения и/или экскреции с мочой, желчью и т. д.; 4) изменение активности естественных ингибиторов и активаторов ферментов.
Классификация и номенклатура ферментов. В зависимости от типа катализируемых реакций все ферменты делят на шесть классов и несколько подклассов и подподклассов (табл. 1.6). В соответствии с этой классификацией каждый фермент обозначают шифром, включающим номера класса, подкласса, подподкласса и порядковый номер фермента в подподклассе. Используют также и тривиальные, обычно
употребляемые названия ферментов (например, аланиновая аминотрансфераза).
Таблица 1.6
| Классификация ферментов (по А.Ш.Бышевскому и О.А.Терсенову) Класс | Типы катализируемых реакций | ||
| № | Название | ||
| 1. | Оксидоредуктазы | Окислительно-восстановительные реакции | |
| 2. | Трансферазы | Реакции межмолекулярного пере- носа: А – В + С = далее = А + В - С | |
| 3. | Гидролазы | Реакции гидролитического расщепления | |
| 4. | Лиазы | Реакции негидролитического расщепления с образованием двойных связей | |
| 5. | Изомеразы | Реакции изменения геометрической или пространственной конфигурации молекулы | |
| 6. | Лигазы, или синтетазы | Реакции соединения двух молекул, сопровождающиеся гидролизом макроэргов | |
Аминотрансферазы
Аминотрансферазы (трансаминазы) — ферменты, играющие важную роль в азотистом обмене, участвуют в расщеплении аминокислот, не использующихся в процессах
биосинтеза. Они катализируют реакцию переаминирования, в которой происходит как бы обмен аминогруппы (NH2) между аминокислотой и кетокислотой (рис. 1.51 и 1.52). Посредником в этом переносе аминогруппы является витамин В6 (точнее, его производное — пиридоксальфосфат), входящий в состав активного центра аминотрансфераз (кофермент). Пиридоксальфосфат (витамин В6) взаимодействует с аминокислотой, принимая на себя аминогруппу (NH2), а затем передавая ее кетокислоте. Реакции переаминирования обратимы и могут протекать в обоих направлениях в зависимости от соотношения концентраций реагирующих компонентов и потребности в них.
Все аминокислоты, за исключением лизина и треонина, подвергаются специфическому воздействию аминотрансфераз. Наибольшее значение имеют две из них: аспартатаминотрансфераза и аланинаминотрансфераза.
Аспартатаминотрансфераза (АсАТ) — катализирует реакцию переаминирования между аспарагиновой и α-кетоглутаровой кислотой. В результате этой реакции (рис. 1.51) аспарагиновая кислота (аспартат), лишаясь своей аминогруппы (NH2), превращается в щавелевоуксусную кислоту (оксалоацетат), а α-кетоглутаровая кислота, приобретая аминогруппу, превращается в глутаминовую кислоту. Обратный ход реакции ведет к образованию аспарагиновой и α-кетоглютаровой кислоты при взаимодействии глутаминовой кислоты и оксалоацетата.
Аланинаминотрансфераза (АлАТ) катализирует аналогичную реакцию между аланином и α-кетоглутаровой кислотой с образованием глутаминовой и пировиноградной кислот (пирувата). При обратном ходе реакции (слева направо) из глутаминовой кислоты и пирувата образуются аланин и α-кетокислота (рис. 1.52).
Главными участниками этих двух реакций являются глутаминовая и аспарагиновая кислоты, которые включаются затем в описанный выше орнитиновый цикл биосинтеза мочевины — главный механизм обезвреживания аммиака в организме.
Аминотрансферазы содержатся практически во всех органах, но наибольшая активность аминотрансфераз обнаружена в печени, скелетных мышцах, сердце и почках. Активность аминотрансфераз в эритроцитах в 6 раз выше, чем в сыворотке крови.
В норме в сыворотке крови присутствует сравнительно небольшое количество аминотрансфераз. Диагностическое значение имеет повышение активности этих ферментов в сыворотке, обусловленное повреждением ткани печени, сердца, скелетных мышц, почек и поступлением ферментов в общий кровоток. Повреждение ткани печени, сердца, скелетных мышц и/или почек, как правило, сопровождается значительным выделением аминотрансфераз в кровоток. Непосредственными причинами повышения активности аминотрансфераз в сыворотке крови являются:
1. некроз или повреждение печеночных клеток любого происхождения (острый вирусный гепатит, хронический гепатит, цирроз печени, опухоли печени, алкогольная интоксикация, обтурационная желтуха, прием некоторых гепатотоксичных лекарственных препаратов);
2. острый инфаркт миокарда (ИМ), острый миокардит;
3. травма или некроз скелетных мышц;
4. гемолиз эритроцитов.
В клинической практике большое значение имеет соотношение активности АсАТ/АлАТ в сыворотке крови (коэффициент де Ритиса).
1. При остром ИМ активность АсАТ выше, чем АлАТ (коэффициент де Ритиса больше 1,3). 2. При остром вирусном и хроническом гепатитах, особенно на ранних стадиях, активность АлАТ выше, чем АсАТ (коэффициент де Ритиса меньше 1,0). Тяжелое поражение печени может изменить это соотношение. 3. При алкогольном гепатите нередко активностьАсАТ оказывается выше, чем АлАТ (коэффициент де Ритиса больше 1,3).
γ-глутамилтранспептидаза (ГГТП)
γ-глутамилтранспептидаза (γ-глутамилтрансфераза ГТТФ), так же как аминотрансферазы, относится к классу трансфераз и активно участвует в азотистом обмене. Фермент катализирует перенос глутаминовой группы с γ-глутаминового остатка на акцепторный пептид или L-аминокислоту.
Наибольшая активность ГГТПобнаруживается в ткани печени, почек, поджелудочной железы. В норме активность фермента в сыворотке крови не превышает 66–106 МЕ.
Повышение активности ГГТП наблюдается при следующих патологических состояниях:
1. обтурации внутрипеченочных и внепеченочных желчных путей (особенно значительно повышение ГГТП, идущее параллельно с увеличением активности щелочной фосфатазы — см. ниже);
2. заболеваниях печени (гепатитах, циррозе печени, опухолях и метастазах в печень), особенно протекающих при явлениях холестаза;
3. панкреатитах и опухолях поджелудочнойжелезы;
4. интоксикациях этанолом (даже при умеренном употреблении алкоголя), наркотиками и седативными средствами (лекарственная интоксикация).
Следует подчеркнуть, что повышение активности ГГТП является одним из самых чувствительных, хотя и неспецифичных, биохимических тестов, указывающих на наличие поражения паренхимы печени, билиарной системы и алкогольной интоксикации. Особенно хорошо активность этого фермента реагирует на алкогольно-токсическое поражение печени, что используется для объективного контроля за эффективностью лечения алкоголизма.
Креатинкиназа (креатинфосфокиназа, КФК)
Креатинфосфокиназа катализирует обратимую реакцию фосфорилирования креатина с образованием креатинфосфата (КФ). Последний является своеобразным резервным макроэргическим соединением, который может быть быстро использован в качестве «аварийного» источника энергии преимущественно в тканях, функционирование которых предъявляет повышенные требования к энергообеспечению (нервная ткань, мышцы).
При обычном (щадящем) режиме функционирования этих тканей обеспечение энергетических потребностей мышц и нервных тканей осуществляется за счет образованияАТФ при окислении углеводов или ацетоацетата. Одновременно здесь накапливается большое количество креатинфосфата (КФ) благодаря прямой реакции, катализируемой КФК:
Креатин + АТФ переходит в КФ + АДФ.
При этом концентрация КФ в 5–8 раз превышает концентрацию АТФ.
При усиленном функционировании нервных тканей и мышц происходит сдвиг равновесия реакции в направлении распада КФ, что дает возможность в течение некоторого времени поддерживать постоянную концентрацию АТФ. Неудивительно поэтому, что наиболее высокая активность КФК обнаруживается в скелетных мышцах, сердце и мозге.
Выделяют три фракции (изофермента) КФК, которые обладают сравнительно высокой органоспецифичностью:
1) ММ-фракция (мышечная);
2) МВ-фракция (сердечная);
3) ВВ-фракция (мозговая).
В норме в сыворотке крови активность КФК не превышает 66,6 ммоль/(ч х л), причем 94–96% этой активности обусловлены ММ-фракцией КФК (мышечной). На долю МВ-фракции (сердечной) в норме приходится всего 2–4% активности КФК, а изофермент ВВ (мозговая фракция) отсутствует в сыворотке крови.
Повышение активности КФК в сыворотке крови обычно связано с повреждением сердечной мышцы или скелетной и, гораздо реже, гладкой мускулатуры. Непосредственными причинами повышения активности КФК и ее изоферментов являются:
1. Острый ИМ (особенно значительно увеличивается МВ-фракция КФК).
2. Острый миокардит, травмы и операции на сердце (преимущественно МВ-фракция КФК).
3. Некоторые клинические варианты нестабильной стенокардии (длительные тяжелые приступы стенокардии, стенокардия Принцметала). В этих случаях иногда может наблюдатьтся умеренное и кратковременное повышение преимущественно МВ-
фракции КФК, или ее значения находятся на верхней границе нормы.
4. Поражение скелетных мышц: полимиозит, дерматомиозит, мышечные дистрофии, любые травмы и операции.
5. Внутривенные и внутримышечные инъекции.
6. Реже — генерализованные судороги, выраженная физическая нагрузка, эмболия легочной артерии, длительная гипотермия, застойная сердечная недостаточность, тяжелые аритмии и т. п.
Снижение активности КФК в сыворотке крови большого клинического значения не имеет, поскольку может быть связано с уменьшением физической активности (гиподинамия) и величины мышечной массы.