Катализатором называют вещество, которое изменяет скорость химической реакции, но само при этом не претерпевает никаких устойчивых изменений. Полагают, что катализатор принимает участие в промежуточных реакциях, но в конце процесса восстанавливается в исходное состояние. Для проведения реакции обычно требуется небольшое количество катализатора. Катализаторы могут ускорять реакцию (положительные катализаторы, катализаторы) или замедлять ее (отрицательные катализаторы, ингибиторы). Действие катализатора специфично: вещество, укоряющее одну реакцию, может оказаться совершенно неэффективным для других реакций. Механизм действия катализаторов исследован не до конца, однако обнаружено, что присутствие положительного катализатора приводит к повышению относительного содержания активных молекул, энергия активации понижается, и скорость реакции возрастает. Зависимость скорости реакции от природы и количества катализатора определяется, как правило, экспериментально.
Можно выделить основные типы катализаторов:
а) гомогенные, если реагирующие вещества и катализатор находятся в одном агрегатном состоянии, не имея границы раздела фаз (в газообразном состоянии или в растворе);
б) гетерогенные, когда реагенты и катализатор находятся в разных агрегатных состояниях (в промышленности чаще всего применяют смесь жидкостей и газов в присутствии твёрдого катализатора);
в) биологические катализаторы – ферменты, это своеобразные белковые тела, участвующие в процессе обмена веществ. Предполагается, что в организме человека одновременно функционируют около 1000 ферментов.
Рассмотрим гомогенный катализ на примере нитрозного способа получения серной кислоты. Явление гомогенного катализа находит свое объяснение в теории промежуточных соединений. Главным положением этой теории является представление о том, что катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя промежуточное соединение, которое затем энергично взаимодействует с другим компонентом, образуя конечный продукт реакции, при этом катализатор восстанавливается в исходном состоянии и вновь может принимать участие в реакциях:
| Основной химический процесс | A + B = AB | SO2 + ½ O2 = SO3 |
| Образование нестойкого промежуточного комплекса с катализатором К | K + B = KB | NO + ½ O2 = NO2 |
| Взаимодействие промежуточного комплекса КВ с компонентом А и образование продукта реакции АВ | A+KB = AB + K | SO2 + NO2 = SO3 + NO |
Катализатор направляет реакцию по другому пути, с образованием других промежуточных частиц, при этом энергия активации каталитической реакции оказывается ниже энергии активации исходной реакции, вследствие этого больше молекул становятся способны преодолеть энергетический барьер, и скорость реакции резко увеличивается (рис. 3).
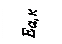
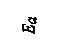

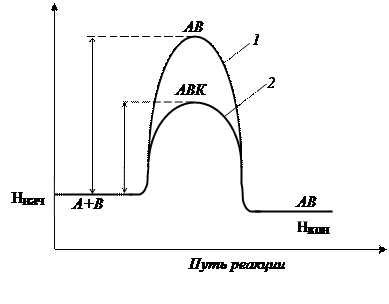
Рис.3. Энергетическая диаграмма реакции без катализатора (1) и с катализатором (2), где E a – энергия активации реакции A + B = AB без катализатора; E aк. – энергия активации каталитической реакции с образованием промежуточного комплекса ABK.
Примером катализатора в жидких однофазных системах может служить ион водорода Н+, который ускоряет многие реакции, протекающие в водных растворах. В последние годы в качестве гомогенных катализаторов стали широко применять комплексные соединения переходных металлов. Одним из распространенных катализаторов является вода, во многих случаях присутствие следов влаги является необходимым условием протекания реакции.
При гетерогенном катализе реакционная смесь и катализатор образуют разные фазы, реагенты находятся в жидкой или газовой фазе, а реакция проходит на поверхности твёрдого катализатора.
В качестве катализаторов могут быть использованы различные вещества: мелкораздробленная и губчатая платина, оксид ванадия V2O5 и соли ванадиевой кислоты – ванадаты, соли меди, никеля, ртути, оксиды алюминия и железа – Al2O3, Fe2O3 и многие другие. При гетерогенном катализе большое значение имеет поверхность соприкосновения реагентов с катализатором, поэтому на практике применяют катализаторы с разветвленной поверхностью: наносят катализатор в мелкораздробленном виде на инертный носитель. В качестве такого носителя может использоваться, например, керамика, асбест, глина и др.
Согласно адсорбционной теории гетерогенного катализа, на поверхности катализатора происходит адсорбция реагентов, т.е. сгущение газообразных или растворенных веществ. Происходит ослабление связей между атомами в молекулах исходных веществ, за счет этого снижается энергия активации катализируемой реакции, которая протекает с высокой скоростью на поверхности катализатора. Молекула продукта уходит с поверхности катализатора, освобождая её для адсорбции следующих молекул исходных веществ. Таким образом, процесс протекает в несколько стадий:
1) адсорбция реагирующих веществ на поверхности катализатора;
2) диффузия веществ вдоль поверхности;
3) реакция молекул, адсорбированных на активных участках катализатора,
4) десорбция продуктов реакции.
Примеры гетерогенного катализа: синтез аммиака (катализатор Fe на асбесте, на Al2O3); окисление SO2 в SO3 контактным методом (катализаторы Pt и Pd на SiO2 и на Al2O3); крекинг нефти (катализаторы – алюмосиликаты и оксид хрома); конверторы-нейтрализаторы в автомобилях и многие др.
Химическое равновесие
Многие химические реакции являются обратимыми, т.е. они не идут до конца и в системе одновременно присутствуют и исходные вещества, и продукты реакции. Система, в которой протекает обратимый процесс, более или менее быстро приходит в такое состояние, когда скорость прямой реакции становится равна скорости обратной реакции, такое состояние называется химическим равновесием. При этом ни прямая, ни обратная реакция не прекращаются, и состав реакционной смеси не изменяется. Основные признаки истинного химического равновесия:
1) Равновесие является подвижным (динамическим), это означает, что система реагирует на различные изменения условий её существования тем, что равновесные концентрации изменяются, причём каждый раз устанавливаются новое равновесие, отвечающее новым условиям существования системы.
2) При установившихся условиях (т.е. при постоянных температуре, давлении и т.п.) соотношение концентраций составных частей системы остается неизменным сколь угодно долго.
3) К данному равновесному состоянию можно подойти с двух сторон. Данное химическое равновесие может быть достигнуто как со стороны прямой, так и обратной реакции. Например, равновесную систему:
H2 + I2 ⇄ 2HI
можно получить двумя путями: брать исходные вещества H2 и I2 и тогда в результате реакции образуется HI; а можно брать HI, который будет распадаться на H2 и I2. И в том, и в другом случае при достижении химического равновесия в реакционной смеси будут одновременно присутствовать все три вещества – H2, I2 и HI, в концентрациях, соответствующих данным условиям.
4) Состояние равновесия в системе соответствует минимальной потенциальной энергии, при этом энергия Гиббса реакции ∆ G =0.