Среди разнообразных химических реакций можно выделить два типа, существенно отличающихся друг от друга. К первому типу реакций относятся те, в ходе которых степень окисления элементов, входящих в соединение, не изменяется. Образование новых молекул в таких реакциях происходит лишь в результате перегруппировки атомов или ионов.
а) Реакции обмена типа AB + ДC = AД + BC (чаще в растворе)
(например, BaCl2+K2SO4=BaSO4 +2KCl);
б) некоторые реакции соединения (CaO+H2O=Ca(OH)2);
в) некоторые реакции разложения (CaCO3=CaO+CO2).
Легко установить, что в ходе указанных реакций степень окисления элементов не изменяется.
Сюда же относятся реакции нейтрализации кислот с основаниями:
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O;
2H2SO4 + Ca(OH)2 = Ca(HSO4)2 + 2H2O.
Гидролиз солей: CuSO4 + 2H2O = Cu(OH)2 + H2SO4.
Реакции, протекающие с изменением степеней окисления элементов, называются окислительно-восстановительными.
Реакции, протекающие с выделением энергии (в виде тепла) называются экзотермическими, а реакции, при которых энергия (тепло) поглощается - эндотермическими.
Реакции, протекающие в гомогенной системе, называются гомогенными, в гетерогенной системе - гетерогенными.
Системой принято называть рассматриваемое вещество или совокупность веществ. Гомогенной называется система, состоящая из одной фазы, гетерогенной - система, состоящая из нескольких фаз. (Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком).
Гомогенная система: NaOH + H2SO4=NaHSO4 + H2O (во всем объеме)
Гетерогенная реакция: Fe + 2HCl = FeCl2 + H2 (на поверхности металла).
Степень окисления и валентность
Ранее было показано, что при образовании ковалентной связи электронные пары располагаются симметрично относительно ядер взаимодействующих атомов и атомы в молекулах никаких зарядов не несут.
При образовании ионных связей валентные электроны переходят от менее электроотрицательных (ЭО) к более электроотрицательным атомам, в результате чего образуются ионы, заряд которых определяется количеством отданных или присоединенных электронов. В молекулах с полярными связями валентные электроны лишь частично смещаются к более ЭО атому, при этом на взаимодействующих атомах возникают электрические заряды, но их величины не являются целочисленными. Например, в молекуле HCl на водороде существует положительный, а на Cl - отрицательный заряды, но их величины меньше 1.
В практических целях (при составлении уравнений окислительно-восстановительных реакций) заряды на атомах в молекулах с полярными связями удобно представлять в виде целых чисел, равных таким зарядам, которые возникли бы на атомах, если бы валентные электроны полностью переходили к более электроотрицательным атомам, т.е. если бы связи были полностью ионными. Такие величины зарядов получили название степеней окисления. Степень окисления любого элемента в простом веществе всегда равна 0.
В молекулах сложных веществ некоторые элементы всегда имеют постоянную степень окисления. Для большинства элементов характерны переменные степени окисления, различающиеся как знаком, так и величиной, в зависимости от состава молекулы.
У щелочных металлов, а также у металлов главной подгруппы второй группы степень окисления во всех соединениях равна соответственно +1 и +2. Постоянную степень окисления, равную -1, имеет фтор. Кислород, как правило, имеет степень окисления -2. У водорода в соединениях с неметаллами степень окисления +1, в гидридах металлов - -1. Для того, чтобы отличить значения степени окисления от зарядов ионов в первом случае знак ставится перед цифрой, во втором - после цифры. Например, Н+1Cl-1, но Na1+Cl1-.
Часто степень окисления (СО) равна валентности и отличается от нее только знаком. Но встречаются соединения, в которых степень окисления элемента не равна его валентности. Как уже отмечалось, в простых веществах СО элемента всегда равна нулю независимо от его валентности. В таблице сопоставлены валентности и степени окисления некоторых элементов в различных соединениях.
| соединение | элемент | валентность | схема | степень окисления |
| О2 | кислород | О=О | ||
| Н2О | 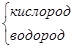
|   О
Н О
Н  Н Н
| -2 +1 | |
| Н2О2 | 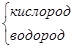
| Н→О – О←Н | -1 +1 | |
| N2 | азот | N≡N | ||
   NH3 NH3
| 
| H N H H | -3 +1 | |
   NF3 NF3
| 
| F N F F | +3 -1 | |
    N2H4 (гидразин) N2H4 (гидразин)
| 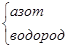
| H H N—N H H | -2 +1 | |
    NH2OH (гидроксил-амин) NH2OH (гидроксил-амин)
| 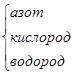
| H N O H H | -1 -2 +1 |
Определение степени окисления элемента в какой либо молекуле сводится к простой арифметической операции, так как сумма степеней окисления атомов всех элементов, входящих в состав молекулы, равна нулю. Например, необходимо определить степень окисления фосфора в фосфорной кислоте Н3РО4. Поскольку у кислорода СО – -2, а у водорода - +1, то для нулевой суммы у фосфора степень окисления должна быть равна 5:
[3(+1)+1(+5)+4(-2)=0].