Тема: «Общая характеристика кальция»
Выполнила: Глухарева М.А.
Проверила: кандидат химических наук Кадомцева А.В.
зав.кафедрой, д.х.н. профессор Гордецов А.С.
г. Нижний Новгород
 2016
2016
Содержание
Стр.
I. Общая характеристика………………………………………………..2
II. Биологическая роль……………………………………………………6
III. Применение в медицине……………………………………………….9
IV. Лекарственные препараты……………………………………………10
V. Аналитические реакции………………………………………..……..12
Список литературы……………………………………………………13
I. Общая характеристика
Ка́льций — элемент второй группы главной подгруппы (А), четвёртого периода периодической системы химических элементов Д. И. Менделеева. Относится к элементам s — семейства. Металл. Элементы-металлы, входящие в эту группу, носят общее название щелочно-земельных. Обозначение – Ca (лат. Calcium). Порядковый номер – 20. Относительная атомная масса – 40,8 а.е.м. Впервые получен в чистом виде Г. Дэви в 1808 году.
Электронно-графическое строение атома кальция
Атом кальция состоит из положительно заряженного ядра (+20), внутри которого есть 20 протонов и 20 нейтронов, а вокруг, по четырем орбитам движутся 20 электронов.
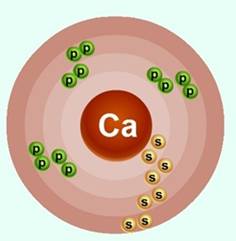
Распределение электронов по орбиталям выглядит следующим образом:
+20 Ca)2)8)8)2.
1 s 22 s 22 p 63 s 23 p 64 s 2.

Внешний энергетический уровень атома кальция содержит 2 электрона, которые являются валентными. Степень окисления кальция равна +2. Энергетическая диаграмма основного состояния принимает следующий вид:

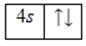
Возбужденного состояния, несмотря на наличие вакантных 3 p — и 3 d -орбиталей, нет.
Молекула и атом кальция
В свободном состоянии кальций существует в виде одноатомных молекул Ca. Приведем некоторые свойства, характеризующие атом и молекулу кальция:
| Энергия ионизации атома, эВ | 6,11 |
| Относительная электроотрицательность | 1,0 |
| Радиус атома, нм | 0,197 |
| Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль | 192,5 |
Нахождение в природе
Из-за высокой химической активности кальций в свободном виде в природе не встречается.
На долю кальция приходится 3,38 % массы земной коры (5-е место по распространенности после кислорода, кремния, алюминия и железа). В природе он встречается в виде многочисленных отложений известняков и мела, а также мрамора, которые представляют собой природные разновидности карбоната кальция CaCO3. В больших количествах встречаются также гипс CaSO4×2H2O, фосфорит Ca3(PO4)2 и содержащие кальций- силикаты.Кальций в виде фосфата входит в состав апатитов,фосфоритов, костей животных. Он содержится в природных водах и почве.
Изотопы кальция
Известно, что в природе кальций может находиться в виде четырех стабильных изотопов 40Ca,42Ca, 43Ca, 44Ca, 46Ca и 48Ca, с явным преобладанием изотопа 40Ca (99,97%). Их массовые числа равны 40, 42, 43, 44, 46 и 48 соответственно. Ядро атома изотопа кальция 40Ca содержит двадцать протонов и двадцать нейтронов, а остальные изотопы отличаются от него только числом нейтронов.
Существуют искусственные изотопы кальция с массовыми числами от 34-х до 57-ми, среди которых наиболее стабильным является 41Ca с периодом полураспада равным 102 тысячи лет.
Физические свойства
Простое вещество кальций мягкий,химически активный щёлочноземельный металл серебристо-белого цвета. На воздухе быстро покрывается слоем оксида, а при нагревании сгорает ярким красноватым пламенем. С холодной водой кальций реагирует сравнительно медленно, но из горячей воды быстро.вытесняет водород, образуя гидроксид.
Получение
В промышленности кальций можно получить с помощью электролиза расплавленного хлорида кальция CaCl2.
CaCl2 = Ca + Cl2
В этом процессе ванна, сделанная их графита, является анодом. Ванна помещается в электрическую печь. Железный стержень, перемещающийся по ширине ванны, а также имеющий возможность подниматься и опускаться, является катодом. Электролитом является расплавленный хлористый кальций, который заливают в ванну. В электролит опускается катод. Так начинается процесс электролиза. Под катодом образуется расплавленный кальций. Когда катод поднимается, в месте касания с катодом кальций застывает. Так постепенно в процессе поднятия катода и происходит наращивание кальция в виде штанги. Затем кальциевую штангу отбивают от катода.
Кальций также получают из оксидов с помощью алюминотермического восстановления.
4CaO + 2Al -> CaAl2O4 + Ca
При этом кальций получается в виде пара. Затем этот пар конденсируется.
II. Биологическая роль
Кальций относится к макроэлементам. Кальция в организме содержится больше, чем других минералов. Суточная потребность в кальции составляет около 1000 мг или 25 ммоль кальция. Общее содержание его в организме – 1,4%. Кальций содержится в каждой клетке человеческого организма. В организме человека при весе 70 кг содержится около 1050 г кальция. Основная масса кальция находится в костях и принимает участие в образовании костной ткани, она не участвует в обменных процессах. Только примерно 1% всей массы кальция организма участвует в обмене веществ и составляет 50-70 тысяч ммоль. Это, так называемый, «обменный» кальций, циркулирующий в крови. Концентрация ионов Ca2+ в сыворотке крови человека составляет 2,5 мкМ, из которых примерно 1,5 мкМ находится в свободной форме, а остальная часть связана с белками (альбумином и b-глобулином), углеводами и другими соединениями. Внутриклеточное содержание ионов свободного кальция не высоко.
Ионы кальция вовлечены в процессы,протекающие на поверхности клетки, активируют многие внеклеточные ферменты и факторы свертывания крови (гемостаза). Кальций участвует в сокращении мышц, в том числе, мышц сердца. Его соединения широко используется в качестве лекарственных препаратов. В связи с изученными реакциями, непосредственный интерес представляет использование хлорида кальция как противоядия при отравлении щавелевой кислотой и ее растворимыми солями.
При продолжительном недостатке кальция может начаться боль в суставах, судороги, сонливость, запоры и дефекты роста.
Долгое игнорирование этих факторов может привести к нарушению сердечного ритма, развитию гипертонии, токсикозам при беременности, увеличению холестерина в крови, остеопорозу, разрушению зубов, слабоумию.
Кальций выводится с мочой и основной причиной его выведения может стать кофе и алкоголь.
У здорового человека избыток кальция может наступить при очень длительном (несколько лет) употребление молочных продуктов, особенно молока в больших объёмах, а так же приём препаратов содержащих кальций и витамин Д. К наиболее известным симптомам характеризующим избыток кальция можно отнести: периодическая тошнота сопровождающая рвотой, слабый или отсутствующий аппетит, запоры, плохая работа почек, аритмия, избыток так же сказывается на психическое состояние – трудно сконцентрироваться, могут быть галлюцинации, общая слабость.
Суточная потребность в кальции:
Количество кальция, для взрослого человека должно составлять 1-1.2 гр. в сутки. Вместе с кальцием в организм должен поступать фосфор из соотношения 1 к 1,5 (Са к Р)
Детям до 3х лет – 0.6 гр.
Детям от 4 до 10 лет – 0.8 гр.
Детям 10-13 лет – 1 гр.
Подросткам 13-16 лет – 1.2 гр.
Старше 16 лет – 1 гр.
Взрослым от 25 до 50 лет – 0.8 -1.2 гр.
Беременным и кормящим матерям – 1500-2000 мг.
Продукты, содержащие кальций:
В большом количестве кальций содержится в молочных продуктах, рыбе и морепродуктах, в мясе, орехах, сыре тофу, в зелени репы, листьях одуванчика, капусте и бобовых.
Усвоение кальция осуществляется в тонком и толстом кишечнике. Лучшему его усвоению способствует кислая среда, витамин Д и витамин С, лактоза, жирные ненасыщенные кислоты. Для кальциевого обмена важен магний, потому что при его недостатке кальций быстрее вымывается из костей и накапливается в мышцах. Плохое усвоение кальция наблюдается при приеме аспирина, щавелевой кислоты, эстрогена и его производных. Кальций с щавелевой кислотой могут образовывать камни в почках.

III. Применение в медицине
В медицине применяют следующие соединения кальция:
1) Карбонат кальция применяется при повышенной кислотности желудочного сока;
2) Хлорид кальция входит в состав кровеостанавливающих средств, применяется в комплексной терапии аллергических реакций, используется при отравлениях щавелевой кислотой;
3) Кальций пангамат (Витамин В15, кальциевая соль сложной органической кислоты) применяют при атеросклерозе и коронарной недостаточности;
4) сульфат кальция применяют для изготовления гипсовых повязок и в стоматологии;