Лабораторная работа №2.
Тема: Карбонильные органические соединения.
Цель: исследовать химические свойства и осуществить качественные реакции на карбонильные соединения.
Опыт 1. Цветная реакция на альдегиды с фуксинсернистой кислотой.
Реактивы и материалы: формальдегид, 40%-ный водный раствор; этаналь; фуксинсернистая кислота.
В две пробирки помещают по 2 капли раствора фуксинсернистой кислоты и добавляют в одну из них 2 капли раствора формальдегида, в другую – 2 капли этаналя. Раствор фуксинсернистой кислоты при добавлении раствора формальдегида постепенно окрашивается в фиолетовый цвет, при добавлении этаналя – в розово-фиолетовый цвет.
Опыт 2. Самоокисление водных растворов формальдегида.
Реактивы и материалы: формальдегид, 40%-ный водный раствор, метиловый красный, раствор.
В пробирку помещают 2—3 капли раствора формальдегида и добавляют 1 каплю индикатора метилового красного. Раствор принимает красную окраску, что указывает на кислую реакцию.
Альдегиды очень легко окисляются. В водных растворах они могут окисляться до кислоты за счет кислорода другой молекулы альдегида, восстанавливая ее в спирт — происходит реакция окислительного восстановления (дисмутации):
O OH
|| |
H-C-H + H-C-H → HCOOH + CH3OH
|
OH
Опыт 3. Окисление альдегидов аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Реактивы и материалы: формальдегид, 40%-ный водный раствор; аммиак, 2 н. раствор; нитрат серебра, 0,2 н. раствор.
В чистую пробирку вводят 2 капли раствора нитрата серебра и прибавляют каплю аммиака. Образующийся бурый осадок гидроксида серебра растворяют, добавляя избыток (1-2 капли) раствора аммиака.
|
|
Затем прибавляют каплю раствора формальдегида и медленно подогревают содержимое пробирки над пламенем горелки. При осторожном нагревании содержимое пробирки буреет и на ее стенках может выделиться серебро в виде блестящего зеркального налета (комплексный ион металла восстанавливается до металлического серебра). Альдегид окисляется до кислоты, которая образует аммониевую соль.
Химизм процесса:
AgNO3 + NH4OH → AgOH + NH4NO3
2AgOH → Ag2O + H2O
AgOH + 4NH4OH → 2[Ag(NO3)2]OH + 3H2O
HCOH + 2[Ag(NO3)2]OH → HCOONH4 + 2Ag + 3NH3 + H2O
Опыт 4. Окисление альдегидов гидроксидом меди (II).
Реактивы и материалы: формальдегид, 40%-ный водный раствор; сульфат меди CuSO4, 0,2 н. раствор; едкий натр, 2 н. раствор.
В пробирку помещают 4 капли раствора едкого натра, разбавляют 4 каплями воды и добавляют 2 капли раствора сульфата меди (II). К выпавшему осадку гидроксида меди (II) прибавляют 1 каплю раствора формальдегида и взбалтывают содержимое пробирки.
Нагревают над пламенем горелки до кипения только верхнюю часть раствора так, чтобы нижняя часть оставалась для контроля холодной. В нагретой части пробирки выделяется желтый осадок гидроксида меди (I) (СuОН), переходящий в красный оксид меди (I) (Сu2О), а иногда на стенках пробирки выделяется даже металлическая медь.
Химизм процесса:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
2Cu(OH)2 + HCOH → HCOOH + Cu2O + 2H2O
Повторите этот опыт, заменив раствор формальдегида раствором этаналя.
Опыт 5. Реакция бензальдегида с гидросульфитом натрия.
Реактивы и оборудование: бензальдегид; гидросульфит натрия (насыщенный раствор); водяная баня.
В пробирку помещают 3 капли бензойного альдегида, добавляют 5 капель насыщенного раствора гидросульфита натрия и энергично встряхивают смесь. Образуются кристаллы гидросульфитного соединения.
|
|
Затем к смеси добавляют 6 капель воды и помещают пробирку в горячую водяную баню. Кристаллы быстро исчезают, в растворе появляются маслянистые капли ощущается характерный запах бензальдегида.
Химизм процесса:

При нагревании в водном растворе гидросульфитное соединение легко разлагается на исходные вещества:
Опыт 6. Свойства ализарина.
Реактивы и оборудование: ализарин; алюминиевые квасцы, насыщенный водный раствор; едкий нарт, 0,1 н. раствор; белая хлопчатобумажная ткань; фарфоровая чашка.
В пробирку помещают 3-5 капель ализарина, добавляют 6 капель щелочи и тщательно взбалтывают. Получается раствор, окрашенный в фиолетовый цвет.
1.В пробирку помещают 2 капли раствора ализарина и добавляют 3 капли раствора квасцов. Образуется оранжево-красный осадок алюминиевого ализаринового лака.
2.Кусочек белой ткани простирывают с мылом и тщательно прополаскивают в воде. В фарфоровую чашечку наливают раствор квасцов, пропитывают им ткань и отжимают.
В пробирку помещают 5 капель щелочного раствора ализарина, нагревают и в горячий раствор погружают кусочек «протравленной» ткани на 1-2 мин. Затем ткань, окрашенную в красный цвет, промывают водой.
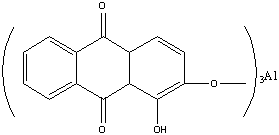 Ализарин, или 1,2-диоксиантрахинон, образует оранжевые игольчатые кристаллы с т. пл. 290°С. Он нерастворим в воде и растворим в обычных органических растворителях. Растворяется он также в водном растворе едкого натра, причем раствор имеет пурпурную окраску.
Ализарин, или 1,2-диоксиантрахинон, образует оранжевые игольчатые кристаллы с т. пл. 290°С. Он нерастворим в воде и растворим в обычных органических растворителях. Растворяется он также в водном растворе едкого натра, причем раствор имеет пурпурную окраску.
Ализарин - протравной краситель. С алюминиевой протравой он дает ярко-красную окраску; с оловянной - фиолетово-красную; с железной - черно-фиолетовую. С ионами этих металлов ализарин образует хелатные соединения за счет групп С=О и группы -ОН, находящейся в α-положении: