СТРОЕНИЕ АММИАКА
 Напомним, что атом азота содержит пять валентных электронов, три из которых неспаренные: 1s12s22p3. У атома водорода один неспаренный электрон 1s1. Так как каждый атом стремится завершить свою последнюю оболочку, для этого атому азота необходимо принять три электрона, а атому водорода необходим ещё один электрон, поэтому между атомом азота и водорода образуется в молекуле аммиака три одинаковые ковалентные полярные связи с помощью общих электронных пар. Таким образом, в молекуле аммиака валентность азота = III, степень окисления равна –3.
Напомним, что атом азота содержит пять валентных электронов, три из которых неспаренные: 1s12s22p3. У атома водорода один неспаренный электрон 1s1. Так как каждый атом стремится завершить свою последнюю оболочку, для этого атому азота необходимо принять три электрона, а атому водорода необходим ещё один электрон, поэтому между атомом азота и водорода образуется в молекуле аммиака три одинаковые ковалентные полярные связи с помощью общих электронных пар. Таким образом, в молекуле аммиака валентность азота = III, степень окисления равна –3.

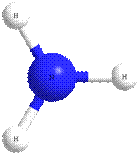
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Кроме ковалентной полярной связи для молекул аммиака характерно и межмолекулярное взаимодействие, а именно межмолекулярные водородные связи. Неподеленная электронная пара атома азота приводит к образованию частично отрицательного заряда на атоме азота, а на атоме водорода частично положительного. Поэтому молекулы аммиака будут притягиваться друг к другу, и между ними будет устанавливаться ещё и водородная связь, которая слабее ковалентных связей (поэтому ее обозначают точками или штрихами).

Именно наличие водородной связи в молекуле аммиака объясняет его растворение в воде и лёгкое сжижение этого газа.
ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА
NH3 – газ без цвета, с резким запахом, почти в два раза легче воздуха, при охлаждении до -33,6∘C он сжижается, а при температуре -77,8∘C превращается в твердое белое вещество, хорошо растворим в воде.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 ∘C) или 700 объёмов (при 20 ∘C) в объёме воды. Полученный раствор называют аммиачной водой. Из-за такой растворимости газообразный аммиак нельзя собирать и хранить над водой.
СПОСОБЫПОЛУЧЕНИЯ АММИАКА
Промышленные способы:
В промышленности аммиак получают синтезом из простых веществ:
при t=450 ∘C; Р=30 Мпа (1000атм.); катализатор — губчатое железо с активирующими добавками (Al2O3; K2O и др.)
3H2+N2→2NH3
Более подробно синтез аммиака рассмотрен в теме "Схема производства аммиака"
Лабораторные способы:
В лаборатории аммиак получают действием щелочей на твердые соли аммония:
(тв.)(тв.)2NH4Cl(тв.)+Ca(OH)2(тв.)=2NH3+2H2O+CaCl2
Собирание - в перевернутую кверху дном пробирку, так как аммиак легче воздуха.
Распознавание аммиака можно проводить несколькими способами:
а) по запаху;
б) по посинению влажной лакмусовой бумажки;
в) по появлению белого дыма от поднесенной стеклянной палочки, смоченной HCl (конц.).