Хром. Соединения хрома.
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
I. Хром.
· С неметаллами
При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором:
4Cr + 3O2 = 2Cr2O3 2Cr + 3Br2 = 2CrBr3
2Cr + 3Cl2 = 2CrCl3 2Cr + 3S = Cr2S3 2Cr + N2 = 2CrN
· С водой. В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3H2O(пар) = Cr2O3 + 3H2
· С кислотами.
В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов соляной и разбавленной серной кислоты, образуя соли хрома (II):
Cr + 2HCl = CrCl2+ H2 Cr + H2SO4 (разб.)= CrSO4 + H2
В присутствии кислорода – соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3+ 6H2O
Концентрированные серная и азотная кислоты на холоду пассивируют хром, однако при сильном нагревании они растворяют хром с образованием солей хрома (III): 2Cr + 6H2SO4  Cr2(SO4)3 + 3SO2 + 6H2O
Cr2(SO4)3 + 3SO2 + 6H2O
Cr + 6HNO3  Cr(NO3)3 + 3NO2 + 3H2O
Cr(NO3)3 + 3NO2 + 3H2O
· С солями.
Хром способен вытеснять многие металлы, например медь, олово, серебро и др. из растворов их солей: Cr +CuSO4 = CrSO4 + Cu
· С щелочами.
Растворы щелочей на хром практически не действуют. Но хром реагирует с щелочными расплавами окислителей. В качестве окислителей используют нитраты калия и натрия, хлорат калия и другие окислители.
Cr + KClO3 + 2KOH  K2CrO4 + KCl + H2O
K2CrO4 + KCl + H2O
2Cr + KClO3 = Cr2O3 + KCl
2Cr + 3KNO3 = Cr2O3 + 3KNO2
II. Соединения хрома.
Соединения хрома (II). Оксид, гидроксид, соли.
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
При высоких температурах оксид хрома (II) диспропорционирует:
3CrO  Cr + Cr2O3
Cr + Cr2O3
Все соединения хрома (II) – сильные восстановители, уже кислородом воздуха окисляются до соединений хрома (III):
4CrO + O2 = 2Cr2O3
4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3
CrCl2 + 4HNO3(конц) = Cr(NO3)3 + NO2↑ + 2HCl↑ + H2O
2CrCl2 + 4H2SO4(конц) = Cr2(SO4)3 + SO2↑ + 4HCl↑ +2H2O
Оксид и гидроксид хрома (II) растворяются в кислотах:
CrO + 2HCl = CrCl2 + H2O
Cr(OН)2 + 2HCl = CrCl2 + 2H2O
Соединения хрома (III).
1) Оксид хрома (III) обладает амфотерными свойствами. Оксид хрома можно получить термическим разложением дихромата аммония:
(NH4)2C2O7 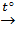 Cr2O3 + N2 + 4H2O
Cr2O3 + N2 + 4H2O
C кислотами оксид хрома (III) образует соли:
Cr2O3 + 6HCl = 2CrCl3 + 3H2O
При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуются хроматы (III), (хромиты):
Сr2O3 + Ba(OH)2 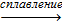 Ba(CrO2)2 + H2O
Ba(CrO2)2 + H2O
Сr2O3 + Na2CO3 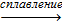 2NaCrO2 + CO2
2NaCrO2 + CO2
C щелочными расплавами окислителей – хроматы (VI) (хроматы)
Cr2O3 + 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
Cr2O3 + 3Br2 + 10NaOH = 2Na2CrO4 + 6NaBr + 5H2O
Сr2O3 + O3 + 4KOH = 2K2CrO4 + 2H2O
2) Гидроксид хрома (III) обладает амфотерными свойствами.
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
2Cr(OH)3 = Cr2O3 + 3H2O
3) Соли хрома (III)
2CrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8H2O
2CrCl3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 + 8H2O
Cr2(SO4)3 + 3Br2 + 16NaOH = 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O
Cr2(SO4)3 + 6KMnO4 + 16KOH = 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O.
Cr2S3+ 30HNO3(конц.)= 2Cr(NO3)3 + 3H2SO4 + 24NO2 + 12H2O
2CrCl3 + Zn = 2CrCl2 + ZnCl2
Cоли, образованные катионами хрома (III) и анионом слабой или летучей кислоты, в водных растворах полностью гидролизуются:
Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
Cоединения хрома (VI)
1) Оксид хрома (VI).Сильно ядовит! Кислотный оксид, который взаимодействует с основными оксидами, основаниями, водой:
CrO3 + Li2O → Li2CrO4
CrO3 + 2KOH → K2CrO4 + H2O
CrO3 + Н2O = Н2CrO4
2CrO3 + Н2O = Н2Cr2O7
Оксид хрома (VI) сильный окислитель: окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III)
4CrO3 → 2Cr2O3 + 3O2↑.4CrO3 + 3S = 2Cr2O3 + 3SO2↑
Окисление солей:
2CrO3 + 3K2SO3 + 3H2SO4 = 3K2SO4 + Cr2(SO4)3 + 3H2O
Соли хромовых кислот – хроматы и дихроматы являются сильными окислителями. Продуктами восстановления которых являются производные хрома (III).
Продукт восстановления в различных средах можно представить схематично:
H2O Cr(OH)3 серо-зеленый осадок
K2CrO4 (CrO42– )
Желтый OH– [Cr(OH)6]3– раствор изумрудно-зеленого цвета
K2Cr2O7 (Cr2O72– ) H+Cr3+ растворы сине-фиолетового цвета
Оранжевый
Изменяя реакцию раствора, можно осуществлять взаимное превращение хроматов в дихроматы:
2K2CrO4 + H2SO4(разб.)= K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
кислая среда
2СrO42–+ 2H+ Cr2O72– + OH-
щелочная среда
Хромат-ион устойчив только в щелочной и, отчасти, в нейтральной среде. В кислотной среде хромат-ион превращается в дихромат-ион по реакции:
2CrO42- + 2H+ = Cr2O7 2- + H2O
Дихромат-ион устойчив только в кислотной и, отчасти, в нейтральной среде. В щелочной среде превращается в хромат-ион:
Cr2O72- + 2OH- = 2CrO42- + H2O
Поэтому в кислотной среде протекают окислительно-восстановительные процессы только с участием иона Cr2O7 2-, а в щелочной – только с участием иона CrO42-.
В нейтральной среде образуется гидроксид хрома (III):
K2Cr2O7 + 3Na2SO3 + 4H2O = 2Cr(OH)3↓+ 3Na2SO4 + 2KOH
2K2CrO4 + 3(NH4)2S + 2H2O = 2Cr(OH)3↓ + 3S↓ + 6NH3↑ + 4KOH
В щелочной – гидроксохроматы (III):
2K2CrO4 + 3NH4HS + 5H2O + 2KOH = 3S + 2K3[Cr(OH)6] + 3NH3 · H2O
2Na2CrO4 + 3SO2 + 2H2O + 8NaOH = 2Na3[Cr(OH)6] + 3Na2SO4
В кислой – соли хрома (III):
K2Cr2O7+ 3H2S +4H2SO4 = K2SO4 + Cr2(SO4)3 + 3S + 7H2O
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
8K2Cr2O7 + 3Ca3P2 + 64HCl = 3Ca3(PO4)2 + 16CrCl3 + 16KCl + 32H2O
K2Cr2O7 + 6FeSO4+ 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 4H2SO4 = Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
K2Cr2O7+ 14HCl = 3Cl2 + 2CrCl3 + 7H2O + 2KCl
K2Cr2O7 + 3SO2 + 8HCl = 2KCl + 2CrCl3 + 3H2SO4 + H2O
2K2CrO4+ 16HCl = 3Cl2 + 2CrCl3 + 8H2O + 4KCl
Задание №32. Хром. Соединения хрома.
1. Сульфид хрома (III) обработали водой, при этом выделился газ и осталось нерастворимое вещество. К этому веществу прибавили раствор едкого натра и пропустили газообразный хлор, при этом раствор приобрел желтое окрашивание. Раствор подкислили серной кислотой, в результате окраска изменилась на оранжевую; через полученный раствор пропустили газ, выделившийся при обработке сульфида водой, и цвет раствора изменился на зеленый. Напишите уравнения описанных реакций.
2. После кратковременного нагревания неизвестного порошкообразного вещества оранжевого цвета начинается самопроизвольная реакция, которая сопровождается изменением цвета на зеленый, выделением газа и искр. Твердый остаток смешали с едким кали и нагрели, полученное вещество внесли в разбавленный раствор соляной кислоты, при этом образовался осадок зеленого цвета, который растворяется в избытке кислоты. Напишите уравнения описанных реакций.
3. Две соли окрашивают пламя в фиолетовый цвет. Одна из них бесцветна, и при легком нагревании ее с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь, последнее превращение сопровождается выделением бурого газа. При добавлении к раствору второй соли раствора серной кислоты желтая окраска раствора изменяется на оранжевую, а при нейтрализации полученного раствора щелочью восстанавливается первоначальный цвет. Напишите уравнения описанных реакций.
4. Гидроксид трехвалентного хрома обработали соляной кислотой. В полученный раствор добавили поташ, выделившийся осадок отделили и внесли в концентрированный раствор едкого кали, в результате осадок растворился. После добавления избытка соляной кислоты был получен раствор зеленого цвета. Напишите уравнения описанных реакций.
5. При добавлении в раствор соли желтого цвета, окрашивающей пламя в фиолетовый цвет, разбавленной соляной кислоты окраска изменилась на оранжево-красную. После нейтрализации раствора концентрированной щелочью цвет раствора вернулся к первоначальному. При добавлении в полученный хлорида бария выпадает осадок желтого цвета. Осадок отфильтровали и в фильтрат добавили раствор нитрата серебра. Напишите уравнения описанных реакций.
6. К раствору сульфата трехвалентного хрома добавили кальцинированную соду. Выделившийся осадок отделили, перенесли в раствор едкого натра, добавили бром и нагрели. После нейтрализации продуктов реакции серной кислотой раствор приобретает оранжевую окраску, которая исчезает после пропускания через раствор сернистого газа. Напишите уравнения описанных реакций.
7) Порошок сульфида хрома (III) обработали водой. Выпавший при этом серо-зеленый осадок обработали хлорной водой в присутствии гидроксида калия. К полученному желтому раствору прилили раствор сульфита калия, при этом вновь выпал серо-зеленый осадок, который прокалили до постоянства массы. Напишите уравнения описанных реакций.
8) Порошок сульфида хрома (III) растворили в серной кислоте. При этом выделился газ и образовался раствор. К полученному раствору добавили избыток раствора аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом черный осадок побелел после обработки его пероксидом водорода. Напишите уравнения описанных реакций.
9) Дихромат аммония разложили при нагревании. Твердый продукт разложения растворили в серной кислоте. К полученному раствору прилили раствор гидроксида натрия до выпадения осадка. При дальнейшем приливании гидроксида натрия к осадку он растворился. Напишите уравнения описанных реакций.
10) Оксид хрома (VI) прореагировал с гидроксидом калия. Полученное вещество обработали серной кислотой, из образовавшегося раствора выделили соль оранжевого цвета. Эту соль обработали бромоводородной кислотой. Полученное простое вещество вступило в реакцию с сероводородом. Напишите уравнения описанных реакций.
11. Хром сожгли в хлоре. Полученная соль прореагировала с раствором, содержащим пероксид водорода и гидроксид натрия. К образовавшемуся желтому раствору добавили избыток серной кислоты, цвет раствора изменился на оранжевый. Когда с этим раствором прореагировал оксид меди (I), цвет раствора стал сине-зеленым. Напишите уравнения описанных реакций.
12. Нитрат натрия сплавили с оксидом хрома (III) в присутствии карбоната натрия. Выделившийся при этом газ прореагировал с избытком раствора гидроксида бария с выпадением осадка белого цвета. Осадок растворили в избытке раствора соляной кислоты и в полученный раствор добавили нитрат серебра до прекращения выпадения осадка. Напишите уравнения описанных реакций.
13. Калий сплавили с серой. Полученную соль обработали соляной кислотой. Выделившийся при этом газ пропустили через раствор бихромата калия в серной кислоте. Выпавшее вещество желтого цвета отфильтровали и сплавили с алюминием. Напишите уравнения описанных реакций.
14. Хром сожгли в атмосфере хлора. К образовавшейся соли добавили по каплям гидроксид калия до прекращения выделения осадка. Полученный осадок окислили перекисью водорода в среде едкого калия и упарили. К полученному твердому остатку добавили избыток горячего раствора концентрированной соляной кислоты. Напишите уравнения описанных реакций.
Хром. Соединения хрома.
1) Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
2Cr(OH)3 + 3Cl2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + Na2SO4 + 3S↓ + 7H2O
2) (NH4)2Cr2O7 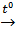 Cr2O3 + N2↑ + 4H2O↑
Cr2O3 + N2↑ + 4H2O↑
Cr2O3 + 2KOH 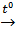 2KCrO2 + H2O
2KCrO2 + H2O
KCrO2 + H2O + HCl = KCl + Cr(OH)3↓
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
3) KNO3(тв.)+ H2SO4(конц.) 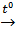 HNO3 + KHSO4
HNO3 + KHSO4
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
4) Cr(OH)3 + 3HCl = CrCl3 + 3H2O
2CrCl3 + 3K2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 6KCl
Cr(OH)3 + 3KOH = K3[Cr(OH)6]
K3[Cr(OH)6] + 6HCl = CrCl3 + 3KCl + 6Н2О
5) 2K2CrO4 + 2HCl = K2Cr2O7 + 2KCl + H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
K2CrO4 + BaCl2 = BaCrO4↓ + 2KCl
KCl+ AgNO3 = AgCl↓ + KNO3
6) Cr2(SO4)3 + 3Na2CO3 + 6H2O = 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
2Cr(OH)3 + 3Br2 + 10NaOH = 2Na2CrO4 + 6NaBr + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7+ H2SO4 + 3SO2 = Cr2(SO4)3 + Na2SO4 + H2O
7) Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
2Cr(OH)3 + 3Cl2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
2K2CrO4 + 3K2SO3 + 5H2O = 2Cr(OH)3 + 3K2SO4 + 4KOH
2Cr(OH)3 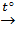 Cr2O3 + 3H2O
Cr2O3 + 3H2O
8) Cr2S3 + 3H2SO4 = Cr2(SO4)3 + 3H2S↑
Cr2(SO4)3 + 6NH3 + 6H2O = 2Cr(OH)3↓ + 3(NH4)2SO4
H2S +Pb(NO3)2 = PbS + 2HNO3
PbS + 4H2O2 = PbSO4 + 4H2O
9) (NH4)2Cr2O7 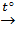 Cr2O3+ N2 + 4H2O
Cr2O3+ N2 + 4H2O
Cr2O3+ 3H2SO4 = Cr2(SO4)3 + 3H2O
Cr2(SO4)3 + 6NaOH = 2Cr(OH)3↓ + 3Na2SO4
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
10) CrO3 + 2KOH = K2CrO4 + H2O
2K2CrO4 + H2SO4(разб.)= K2Cr2O7 + K2SO4 + H2O
K2Cr2O7+ 14HBr = 3Br2 + 2CrBr3 + 7H2O + 2KBr
Br2 + H2S = S + 2HBr
11) 2Cr + 3Cl2 = 2CrCl3
2CrCl3 + 10NaOH + 3H2O2 = 2Na2CrO4 + 6NaCl + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 3Cu2O + 10H2SO4 = 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
12) 3NaNO3 + Cr2O3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
CO2 + Ba(OH)2 = BaCO3↓ + H2O
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
BaCl2 + 2AgNO3 = 2AgCl↓ + Ba(NO3)2
13) 2K + S = K2S
K2S + 2HCl = 2KCl + H2S↑
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
3S + 2Al = Al2S3
14) 2Cr + 3Cl2 = 2CrCl3
CrCl3 + 3KOH = 3KCl + Cr(OH)3↓
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
2K2CrO4 + 16HCl = 2CrCl3 + 4KCl + 3Cl2 + 8H2O