Первичным продуктом кислород-зависимой биоцидной системы лейкоцитов является супероксидный радикал (О2-·). В основе его микробицидного и повреждающего действия лежат реакции, в которых О2-· выступает в роли как хорошего восстановителя (Е0 О2/О2-· =-0.33В), так и сильного окислителя (Е0 О2-·/Н2О2=+0.89В).
Специализированным генератором О2-· в лейкоцитах служит уникальный по своим свойствам фермент – NADPH-оксидаза, использующий в качестве источника восстановительных эквивалентов для О2 NADPH. Этот фермент представлен низкопотенциальным (Е0'=-0.245В) цитохромом b, состоящим из двух субъединиц: (22 kDa) и (91 kDa), и обладающим FAD-связывающим участком в тяжелой субъединице. В отличие от большинства известных электрон-транспортных цепей организация NADPH-оксидазы не требует участия убихинона для осуществления трансформации двухэлектронного переноса от пиридиннуклеотида на одноэлектронный к цитохрому.
Простейшая схема механизма генерации О2-· NADPH-оксидазой может быть представлена следующей цепью редокс-взаимодействий:
2е- 2е- е- e-
NADPH ® FAD ® цит.b ® 2 O2 ® 2 O2-·
Е0=-0.32В Е0=-0.28В Е0=-0.245В Е0=-0.16В
Специфичность фермента к его субстратам и кофакторам (по параметру Км) характеризуется следующими значениями: FAD - 60 нM; NADPH - 0.05 мМ (NADH - 1.0 мМ); О2 - 0.03мМ. Активность NADPH-оксидазы по числу оборотов в отношении восстановления О2 составляет 1000 - 2000 мин-1. Следует подчеркнуть, что такое значение Км NADPH-оксидазы характерно для первых трех минут от момента активации клетки, после чего наступает пролонгированная фаза продукции О2-·, характеризующаяся на порядок меньшей величиной константы Михаэлиса (Км = 0.004мМ). Благодаря этому обеспечивается эффективность продукции супероксидного радикала даже на поздних (гипоксических) этапах развития воспалительного процесса. Концентрация О2 в этих условиях составляет около 12мкМ. Внутри же фагосомы концентрация кислорода составляет лишь 11.2 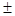 3.4мкМ даже в аэробных условиях.
3.4мкМ даже в аэробных условиях.
Для нейтрофилов как продуцентов О2-· приведенное выше значение константы Михаэлиса фермента в отношении NADPH реализуется лишь в условиях закисления среды (при рН6), что имеет место в фаголизосоме фагоцита или в очагах воспаления – области функционирования этих клеток. Напротив, при физиологических рН, например, в системном кровотоке (где активация нейтрофилов не просто нежелательна, но и опасна), эта константа выше: Км=0.3мМ. В данных условиях снижается сродство NADPH-оксидазы к кислороду как ее субстрату. В тоже время значение Км для NADH (1.0мМ), который не является специализированным субстратом NADPH-оксидазы, не зависит от величины рН реакционной среды.
В целом стимулированные нейтрофилы генерируют супероксидный радикал со скоростью 117 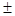 30 наномолей О2-·/мин/107клеток. Примерно 80% от этого количества О2-· подвергается спонтанной дисмутации до Н2О2. Темп производства нейтрофилами супероксидного радикала сильно зависит от концентрации этих клеток, напоминая эффект «групповой супрессии», регистрируемый в микробиологических и клеточных культурах.
30 наномолей О2-·/мин/107клеток. Примерно 80% от этого количества О2-· подвергается спонтанной дисмутации до Н2О2. Темп производства нейтрофилами супероксидного радикала сильно зависит от концентрации этих клеток, напоминая эффект «групповой супрессии», регистрируемый в микробиологических и клеточных культурах.
Поскольку цитохром b-0.245 всегда локализован на поверхности мембраны клетки, а источник электронов для него – в ее цитозоле, то активация NADPH- оксидазы ведет к деполяризации мембраны (около 30-50 мВ). Для удаления из цитозоля Н+ (в качестве противоионов О2-·) NADPH-оксидаза ассоциирована с протонными каналами. Причем, активность как фермента, так и Н+-каналов сопряжены общей регуляцией посредством арахидоновой кислоты, что обеспечивает стехиометрию процесса (подкисление области функционирования О2-·): 8 Н+/10 О2-·. В физиологических условиях это соотношение ионов полностью соответствует эквивалентности их концентрационных активностей. Суммарная "энергия активации" процесса генерации супероксидного радикала нейтрофилом оценивается в интервале значений, равном 13-15 ккал/моль.
NADPH-оксидаза активируется множеством растворимых и корпускулярных агентов, реализующих свое действие через специфические рецепторы на поверхности лейкоцита. Другая группа активаторов представлена искусственными субстанциями и осуществляет свое действие внутриклеточно (форболовые эфиры, ионы фтора и др.), либо путем неспецифического возмущения клеточной мембраны. Все это ведет к многократному увеличению потребления клеткой молекулярного кислорода, который практически весь (около 90%) трансформируется в О2-·.
Рассмотрим молекулярный механизм активации О2-· нейтрофилами. В плазматической мембране клетки активированная NADPH-оксидаза представлена более сложной (надмолекулярной) структурой, чем это было представлено выше (субъединичной). В ее состав включены еще три компонента, локализующиеся в цитоплазме неактивированных клеток и необходимые для активации процесса генерации О2-·. Два компонента специфичны только для NADPH-оксидазы: 47кДа-белок и 67 кДа-белок, а третий - представлен G-белком семейства rac с молекулярной массой 21 кДа (классифицируемый как p21rac2). При активации NADPH-оксидазы происходит очень быстрая самосборка всего ферментного комплекса (например, при стимуляции клетки хемоаттрактантом - в течение 2 сек.). G белок оказывается вовлеченным в трансдукцию сигнала для генерации О2-· от рецепторов к различным лигандам-медиаторам воспаления (C5a, PAF, N-формилметиониловые пептиды и др.), что сопряжено с активацией фосфоинозитидазы С (варианта фосфолипазы С – фС). Это провоцирует фС-зависимое расщепление в мембране лейкоцита инозитол-4,5-дифосфата с освобождением двух вторичных мессенджеров: диацилглицерола (ДАГ) и инозитол-1,4,5-трифосфата (IP3). В дальнейшем процесс активации О2-·- продукции лейкоцитами осуществляется по двум разным путям. IP3, как очень кислая гидрофильная молекула, освобождаясь в цитозоль, индуцирует транзиторный выброс Са2+ из внутриклеточных компартментов. Увеличение уровня Са2+ в цитозоле инициирует множество Са-зависимых процессов, включая фосфолипаза А2-зависимое освобождение арахидоновой кислоты (сопрягающей действие протонного насоса с NADPH-оксидазой) и кальмодулин-зависимое фосфорилирование белков.
С другой стороны, освобожденный под действием фС ДАГ связывается с Са2+/фосфолипидзависимой протеинкиназой и активирует ее. В результате фермент фосфорилирует целую группу белков - участников защитных реакций, включая и рецепторы для IL-2, трансферрина, а также антигены главного комплекса гистосовместимости. Аналогично другим типам клеток, в покоящихся нейтрофилах эта протеинкиназа С также слабо взаимодействует с мембраной, аффинитет которой значительно возрастает в результате активации фермента ДАГ-ом и в ассоциации с фосфатидилсерином (кофактор протеинкиназы С). Как степень транслокации фермента в мембрану, так и усиление кофакторных свойств фосфатидилсерина зависят от Са2+. Кооперация двух путей процесса активации О2-·-продукции лейкоцитами реализуется на уровне их протеинкиназ: кальмодулин-зависимой и протеинкиназы С. Эксперименты in vitro с очищенными компонентами NADPH-оксидазы показали, что ее активация может осуществляться фосфорилированием этого фермента в области FAD-связывающего участка большой субъединицы. Активация NADPH-оксидазы осуществляется путем фосфорилирования ее цитоплазматического компонента - 47кДа-белка, что и обеспечивает быструю самосборку этой многокомпонентной системы. Дефосфорилирование же этого белка специфической протеинфосфатазой ведет к быстрому разложению указанной надмолекулярной структуры.
Продукция О2-· лейкоцитами является дозозависимой по отношению к данному конкретному стимулятору. Кроме того, эффективность производства клетками супероксидного радикала усиливается при стимуляции нейтрофилов лигандами через различные рецепторы, проявляя признаки аддитивности или синергизма. Причем, в последнем случае наблюдается так называемый праймирующий эффект, когда предобработка клеток субоптимальными или неэффективными дозами одного стимулятора резко усиливает ответ на другой.
Механизмы терминации активности NADPH-оксидазы до конца не исследованы. Одним из элементов системы терминации изученным в настоящее время является специфическая протеинфосфатаза, дефосфорилирующая 47 кДа-компонент NADPH-оксидазы, что ведет к разборке всей надмолекулярной структуры, другим – является семейство диацилглицеролкиназ (ДАГ-киназ), фосфорилирующих ДАГ и, таким образом, предотвращающих активацию протеинкиназы С. Известны также молекулы-сигнализаторы (ингибиторы), «оповещающие» нейтрофил о включении механизмов терминации О2-·–продукции. Такую роль выполняют комплексы α1-антихимотрипсина с соответствующими протеиназами. Причем, комплексы с ферментами другой антипротеиназы, α2-макроглобулина, ингибируют продукцию О2-· моноцитами/макрофагами. В отношение этой же группы клеток аналогичную функцию выполняет и IL-4.
Существуют альтернативные механизмы активации лейкоцитов для продукции О2-·. Например, сфингомиелиновый путь, где в результате взаимодействия сигнальной молекулы с рецептором активируется сфингомиелиназа, гидролизующая сфингомиелин на фосфохолин и церамид, который является вторичным мессенджером. Некоторые из сигнальных молекул (например, цитокин) могут использовать оба пути активации О2-·-продукции. Идентифицирована и особая форма протеинкиназы С, активация которой может осуществляться протеолитически, где в качестве протеиназы выступает калпаин.
Исходно NADPH-оксидаза локализуется на внешней стороне плазматической мембраны и генерируемые ею О2-·-радикалы поступают во внеклеточную среду – это может служить одним из механизмов упреждающего поражения микроба еще до его захвата фагоцитом. Но это может играть и негативную роль: быть причиной повреждения тканей в очаге воспаления. Тем более, что закисление среды создает условие для образования и других форм АМК.
Таким образом, образование супероксидного радикала при помощи специализированного механизма является высокоорганизованным процессом, в отличие от самопроизвольно протекающих реакций окисления, описанных выше. Механизм этот в системе антимикробных факторов фагоцитов выполняет стратегическую роль и его дефекты, как правило, являются несовместимы с жизнедеятельностью (грануломатозная болезнь новорожденных). Во многом это обусловлено и тем обстоятельством, что помимо собственной биоцидной функции NADPH-оксидаза вступает в кооперацию с наиболее мощным микробицидным фактором защитных клеток - миелопероксидазой (МПО), локализующейся в пероксидазосомах нейтрофила, где NADPH-оксидаза является поставщиком субстрата - Н2О2 (продукта дисмутации О2-·) для деятельности этого фермента, а также субстрата и кофактора (О2-·), контролирующего эффективность антимикробного действия миелопероксидазы.