Карбонат кальция (CaCO3) в природе встречается в виде минералов – кальцита, арагонита и витерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц.
Получить карбонат кальция можно при пропускании углекислого газа (CO2) через избыток раствора гидроксида кальция (Ca(OH)2). Эту реакцию используют для обнаружения углекислого газа и определения его количественного содержания в воздухе.
Нерастворимый в воде карбонат кальция может растворяться в кислотах, например в соляной кислоте (HCl).
Карбонат кальция используется как белый пищевой краситель Е170. Являясь основой мела, он используется для письма на школьных досках, используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве. Кроме того, карбонат кальция является важнейшим компонентом продукции бытовой химии – средств для чистки сантехники, кремов для обуви.
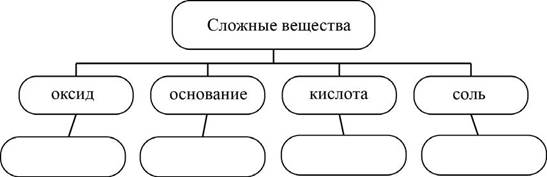
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом выше тексте.
1. Составьте молекулярное уравнение реакции получения карбоната кальция. Ответ:
2. Укажите, происходит ли в ходе этой реакции изменение степеней окисления атомов. Ответ:



© 2018 Федеральная служба по надзору в сфере образования и науки Российской Федерации 4
| ВПР. Химия. 11 класс. Вариант 10 | Код |

7 1. Составьте молекулярное уравнение реакции карбоната кальция с соляной кислотой,
о которой говорилось в тексте. Ответ:


2. Укажите признак, который наблюдается при протекании этой реакции.
Ответ:



8 При исследовании минерализации бутилированной воды в ней были обнаружены следующие анионы: Cl–, F–, NO3–. Наличие одного из перечисленных ионов было доказано в результате добавления к воде раствора AgNO3.
1. Какое изменение наблюдается при проведении описанного опыта? (Концентрация веществ достаточна для проведения анализа.)
Ответ:

2. Запишите сокращённое ионное уравнение протекающей химической реакции. Ответ:


9 Дана схема окислительно-восстановительной реакции:
KI + Cl2 + H2O → KIO3 + HCl
1. Составьте электронный баланс этой реакции. Ответ:
2. Укажите окислитель и восстановитель. Ответ:
3. Расставьте коэффициенты и запишите получившееся уравнение реакции. Ответ:




10 Дана схема превращений:
Al → Al2(SO4)3 → Al(OH)3 → AlCl3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
1)

2)

3)

© 2018 Федеральная служба по надзору в сфере образования и науки Российской Федерации 5
| ВПР. Химия. 11 класс. Вариант 10 | Код | ||||||||||||||||||
| Для выполнения заданий 11–13 используйте вещества, структурные формулы которых | |||||||||||||||||||
| приведены ниже: | |||||||||||||||||||
| 1) CH3 | CH2 | OH | 2) CH2 | CH2 | 3) CH | CH | |||||||||||||
| 4) CH2 | CH | CH | CH2 | 5) CH | CH | CH | C | O | |||||||||||
| OH | |||||||||||||||||||
| 11Из приведённого | перечня выберите | вещества, | которые | соответствуют указанным |








в таблице классам/группам органических соединений. Запишите номера этих веществ
в соответствующую графу таблицы.
| Алкадиен | Карбоновая кислота |






12 В предложенные схемы химических реакций впишите структурные формулы пропущенных веществ, выбрав их из приведённого выше перечня, и расставьте коэффициенты.

| 1)................................ | + H2 | Pt | CH3 | CH2 | CH2 | CH3 | ||||||
| 2)................................ | + Na | CH3 | CH | ONa + H2 | ||||||||
| 13Уксусный | альдегид – летучая | жидкость | с фруктовым запахом. Его используют | |||||||||





в производстве уксусной кислоты, некоторых полимеров. В лабораторных условиях уксусный альдегид можно получить в соответствии с приведённой схемой превращений:
| СaC | H2O | X | CH | C O | ||||
| H | ||||||||



Выберите из предложенного перечня вещество Х и запишите уравнения двух реакций,
с помощью которых можно осуществить эти превращения. При написании уравнений реакций используйте структурные формулы органических веществ.
1)

2)

Запишите название вещества X.
3)

© 2018 Федеральная служба по надзору в сфере образования и науки Российской Федерации 6
| ВПР. Химия. 11 класс. Вариант 10 | Код |

14 Одним из важных понятий в экологии и химии является «предельно допустимая концентрация» (ПДК). ПДК – это такая концентрация вредного вещества в окружающей
среде, присутствуя в которой постоянно, данное вещество не оказывает в течение всей жизни прямого или косвенного неблагоприятного влияния на настоящее или будущее поколение, не снижает работоспособности человека, не ухудшает его самочувствия и условий жизни.
ПДК хлора в воздухе составляет 0,03 мг/м3.
В помещении столовой площадью 32 м2 и высотой потолка 3 м при влажной уборке
с использованием хлорсодержащих дезинфицирующих средств в воздух выделилось 2,4 мг хлора. Определите и подтвердите расчётами, превышает ли концентрация хлора в воздухе данного помещения значение ПДК. Предложите способ, позволяющий снизить концентрацию хлора в помещении.

Ответ:




15 Для борьбы с заболеваниями садово-огородных культур используют 3%-ный раствор перманганата калия. Рассчитайте массу перманганата калия и массу воды, которые необходимы для приготовления 5 кг такого раствора. Запишите подробное решение задачи.

Ответ:



© 2018 Федеральная служба по надзору в сфере образования и науки Российской Федерации 7