Одноатомные спирты и вода. Сходства и отличия. Гидрофильность спиртов как результат особенностей строения молекулы
Введение
Вода есть суть всего живого. Она является жизненно необходимым, незаменимым веществом и распространена повсеместно на нашей планете. С другой стороны, спирты являются одними из самых важных молекул в органической химии. Их можно синтезировать из множества соединений и их можно превратить в ряд других веществ. Изучение и сопоставление их сходств и различий представляет большой интерес. В связи с этим целью данного реферата будет являться проведение такого анализа. Известно много научной литературы и различных книжных изданий, посвященных изучению воды и различных спиртов. Здесь речь будет идти только об одноатомных спиртах и воде с точки зрения различных аспектов.
Вода является химическим веществом сформированным сочетанием кислорода и водорода. С другой стороны, спирт представляет собой органическое соединение, содержащее гидроксильные группы  , которые присоединены к атому углерода, принадлежащему алкильной группе. Алкильная группа может быть предельной, непредельной или ароматической.
, которые присоединены к атому углерода, принадлежащему алкильной группе. Алкильная группа может быть предельной, непредельной или ароматической.
Молекулу одноатомного спирта (имеет одну гидроксильную группу в своем составе) можно сравнить с молекулой воды (рис. 1). В спирте, гидроксильный кислород и два атома присоединенные к нему находятся в одной плоскости и имеют угол связи приблизительно 104°. Это очень похоже на молекулу воды.
И в спирте и в воде, углы связей отражают эффект отталкивания электронов и увеличение стерического объема заместителей на центральном атоме кислорода. Электроотрицательность кислорода способствует несимметричному распределению заряда, создавая частичный положительный заряд на водороде и частичный отрицательный заряд на кислороде. Такое неравномерное распределение электронной плотности в связи О-Н создает диполь. Кроме того, из-за высокой электроотрицательности кислорода по отношению к электроотрицательности углерода, связь О-Н короче (1,41 Å для C-O против 1,51 Å для C-C) и сильнее.

Рис. 1 Молекулы воды и метанола
Вообще, термин «вода» относится к жидкому состоянию вещества. Кроме того, она существует в двух других формах, как лед в твердом состоянии и как пар в газообразном состоянии. В зависимости от условий и конкретно взятого спирта они также могут быть в разных состояниях. Наиболее распространенный тип спирта, который используется для приготовления большинства алкогольных напитков, это этанол. Кроме того, спирт в общих терминах точно относится к этанолу. Спирты в основном подразделяются на три группы: первичные, вторичные и третичные, в зависимости от строения.
Говоря о химическом составе воды, одна молекула воды состоит из одного атома кислорода ковалентно связанного с двумя атомами водорода, химическая формула  . Общая формула предельных одноатомных спиртов:
. Общая формула предельных одноатомных спиртов:  .
.
Вода не имеет вкуса, запаха в условиях стандартной температуры и давлении. Спирты в жидком состоянии, как правило, имеют специфический запах. Большинство спиртов имеют небольшой вяжущий вкус.
Основное правило растворимости: «Подобные молекулы растворяют подобные». Полярные вещества растворяются в полярных растворителях, неполярные соответственно в неполярных. Спирты смешиваются с водой согласно следующему правилу: органическое соединение растворимо в воде, если отношение углерода к кислороду в веществе не превышает 4:1. Растворимости некоторых одноатомных спиртов приведены в таблице 1.
Таблица 1 Растворимости спиртов в воде
| Спирт | Формула | Растворяемость:
г/100 г 
|
| Метанол | 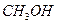
| Неограниченно |
| Этанол | 
| Неограниченно |
| Пропанол | 
| Неограниченно |
| Бутанол | 
| 8,88 |
| Пентанол | 
| 2,73 |
| Гексанол | 
| 0,602 |
| Гептанол | 
| 0,174 |
Гидроксильная группа спиртов полярна и, следовательно, гидрофильна, в то время как углеродная цепь является неполярной и гидрофобной. С удлинением углеродной цепочки молекула становится в целом более неполярной и, следовательно, менее растворимой в полярной воде.
Рассмотрим другие свойства спиртов (рис. 2). Из рисунка видно, что с ростом углеродной цепи диэлектрическая постоянная понижается, что в основном объясняется большей полярностью воды по сравнению со спиртами.
Диэлектрическая проницаемость Молекулярная масса


Рис. 2 Зависимость диэлектрической проницаемости и молекулярной массы от n, где n – число атомов углерода в молекуле. Таким образом, для воды n = 0.
Точка кипения воды изменяется в зависимости от барометрического давления в области. Это характерно для большинства жидкостей. Например, на уровне моря, вода закипает при 100°, тогда как на большой высоте, как на вершине горы, вода кипит при температуре около 68°. Температура замерзания воды, она же и температура плавления, равна 0°.
Интересно, что вода на дне океанов, поблизости к геотермальным отверстиям может продолжать оставаться в жидкой форме даже при низкой температуре. Спирт (этанол), с другой стороны имеет статическую точку кипения; он кипит при температуре 78,29°.
Спирты кроме того имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать (табл. 2). Это объясняется наличием межмолекулярных водородных связей. Энергия водородной связи гораздо ниже, чем энергия ковалентной связи. Для метанола энергия водородной связи составляет 16,7 кДж/моль, тогда как связи C–H, C–O и O–H имеют энергию 391,7, 383,5 и 428,8 кДж/моль соответственно. Влияние водородных связей на физические свойства спиртов весьма большое.
Таблица 2 Температуры плавления и кипения некоторых спиртов
| Спирт | Формула | Tпл, °С | Tкип, °С |
| Метанол | 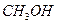
| −97,78 | 64,7 |
| Этанол | 
| −114,65 | 78,3 |
| Пропанол | 
| −124,10 | 97,2 |
| Пропанол-2 | 
| −87,95 | 82,5 |
| Бутанол | 
| −88,64 | 117,8 |
| Бутанол-2 | 
| −114,70 | 99,5 |
| Пентанол | 
| −77,59 | |
| Гексанол | 
| -47,40 | 157,1 |
| Гептанол | 
| −32,80 | 176,3 |
| Пропен-2-ол-1 | 
| −129 | 96,9 |
| Пропин-2-ол-1 | 
| −48 | 113,6 |
Химические свойства спиртов определяются наличием в них гидроксильной группы. Поскольку гидроксильная группа является полярной, она может гетеролитически диссоциировать, особенно, под действием сильных оснований. Таким образом, спирты проявляют свойства слабых кислот:

Как слабые кислоты, спирты диссоциируют по связи O–H с образованием алкоксид-иона. В водном растворе кислотность спиртов снижается с увеличением молекулярной массы и разветвлённости углеводородной цепи (рис. 3). Это связано с увеличением положительного индуктивного эффекта алкильных заместителей в данном ряду и уменьшением устойчивости образующегося алкоксид-иона за счёт локализации отрицательного заряда на атоме кислорода.

Рис. 3 Сравнение показателя кислотности для некоторых спиртов и других веществ
В качестве слабой кислоты спирты как и вода будут взаимодействовать с щелочными и щелочноземельными металлами, а также их гидридами:


Вода рассматривается как универсальный растворитель, она растворяет большинство веществ, таких как соли, сахара, кислоты, щелочи и даже некоторые газы, такие как углекислый газ и кислород. Это необходимо для здорового образа жизни всех форм жизни, поскольку вода является одним из важнейших компонентов в растительных и животных клетках. С другой стороны, большинство спиртов потребляются в качестве крепких напитков. В ряде случаев спирт также используется в качестве топлива. Спирт также находит применение в медицинских, научных и промышленных экспериментах. Одноатомные спирты являются токсичными веществами в отличие от воды. Например, этанол, попадая в организм человека, приводит к образованию токсичного ацетальдегида. Кроме того он негативно влияет на другие обменные процессы в живом организме, например изменяет концентрацию гормонов.
Заключение
Таким образом, проведенный анализ литературы показал, что вода и спирты имеют как ряд сходств, так и множество различий. Это выражается и строении, и в свойствах, и даже в применении данных веществ. Например: сходства связанные со строением: содержат кислород и водород, являются сложными соединениями, состоящими из атомов, сформированы ковалентными связями и не содержат атомов металлов, низшие спирты, как и вода, являются жидкостями при комнатной температуре; различия обусловленные строением: спирты содержат углерод в отличие от воды, они имеют более низкую плотность. Как было сказано выше, вода для нас незаменима, но и некоторые спирты выполняют важные функции в нашем организме.
Список использованных источников
1. Нейланд О. Я. Органическая химия: Учеб. для хим. вузов. – М.: Высшая школа, 1990. – 751 с.
2. Рабинович В. А., Хавин З. Я. Краткий химический справочник. – Изд. 3-е, испр. и доп. – Ленинград: Химия, 1991. – 433 с.
3. Робертс Дж., Касерио М. Основы органической химии / Под редакцией академика Несмеянова А. Н.. – 2-е, дополненное. – М.: Мир, 1978. – Т. 1. – 419 с.
4. https://ru.wikipedia.org/wiki/%D0%A1%D0%BF%D0%B8%D1%80%D1%82%D1%8B