II ЗАКОН ТЕРМОДИНАМИКИ
I. Равновесные и обратимые процессы
1. Равновесный процесс
Определение Равновесным или квазистатическим называется некий идеализированный процесс, в котором система под влиянием б/малых воздействий проходит через непрерывный ряд состояний, сколь угодно близких к равновесным
Общие условия осуществления и свойства равновесного процесса
а) равенство сил действующих на систему извне и противо-действующих со стороны системы, точнее б/малое их различие
б) двусторонность, т.е. способность процесса менять свое направление при изменении воздействующей силы на б/м величину.
в) равенство температуры системы и внешней среды (б/м различие)
г) отсутствие потерь энергии на преодаление сил трения. Система совершает максимальную работу, 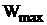 .
.
д) бесконечно медленное течение процесса
2. Неравновесный (реальный) процесс -
проходит с конечной скоростью, обусловленной конечной разностью температур и давлений между системой и окружающей средой. В этом случае прекращение внешнего воздействия не приводит к немедленному прекращению процесса. Процесс будет протекать до установления состояния равновесия и б/м воздействием его не повернуть вспять. Следовательно, неравновесный процесс является необратимым (односторонним).
Работа неравновесного процесса 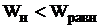 .
.
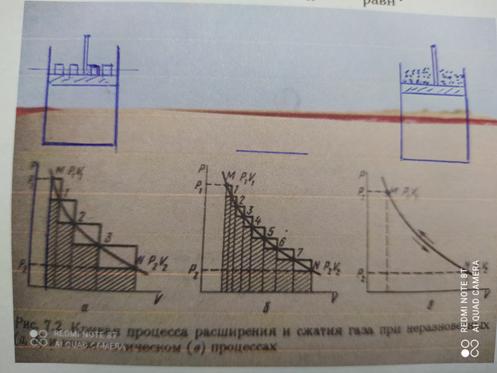
Поясняющая схема равновесного и неравновесного процессов
II. Самопроизвольные и несамопроизвольные процессы
1. Все ли процессы, возможные с точки зрения I закона т-ки имеют место быть в действительности? I закону т-ки не противоречат любые процессы, лишь бы выполнялся закон сохранения энергии)
По возможности протекания (без какого-либо внешнего воздействия) все процессы в окружающем нас мире можно разделить на самопроизвольные и несамопроизвольные.
2. Самопроизвольные – это процессы, которые протекают сами по себе без какого-либо воздействия извне.
а) односторонние, необратимые процессы, приводящие систему, в конечном счете, в состояние равновесия
б) диффузия, смешение, растворение, 
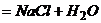
3. Несамопроизвольные – процессы, которые не идут сами по себе и для их протекания требуется затрата работы извне (разделение смеси на чистые вещества, 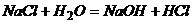 )
)
4. Т.о. I закон не в состоянии дать ответ на вопрос о возможности осуществления того или иного процесса. Ответ на вопрос о том, какие процессы в природе возможны, а какие нет, дает II закон.
III. Формулировки II начала термодинамики
Второе начало не имеет столь простого и общепринятого определения, как первое, и формулируется различным образом в зависимости от той группы явлений к которой оно относится.
1. Постулат Рудольф Клаузиуса (1850г) - Единственным результатом любой совокупности процессов не может быть переход теплоты от менее нагретого тела к более нагретому. Иначе, теплота не может переходить от холодного тела к горячему сама собой, даровым образом, без воздействия внешних сил
2. ФормулировкаУильямаТомсона (Кельвина, 1854г) – “невозможен такой периодический процесс, единственным результатом которого было бы превращение теплоты в работу”. Другими словами невозможно теплоту какого-либо тела полностью превратить в работу, не производя никакого другого действия, кроме охлаждения этого тела. У. Томсон - понятие абсолютной т/д шкалы температур (1848г).
3. Хотя формулировки II закона носят характер частных качественных формулировок, все они эквивалентны. Анализ любой из них приводит к выводу, что в природе существует некоторая функция состояния, по знаку изменения которой можно установить является данный процесс самопроизвольным или нет. Эта функция состояния, свойства которой позволяют математически сформулировать II закон т-ки была введена Клаузиусом (1865г.) и называется ЭНТРОПИЯ
ЭНТРОПИЯ
I. ПОНЯТИЕ. Математическое выражение 2-го закона т-ки.
1). Математическое выражение второго закона т-ки и появление термина “энтропия”, связано с анализом работы тепловой машины по идеальному циклу Карно (1824 г, Сади Карно – французский физик). Напомню, что этот цикл, в результате которого система возвращается в исходное состояние, включает два изотермических и два адиабатических равновесных процесса.
Из математического анализа цикла Карно следует, что интеграл от б/м величины приведенной теплоты по замкнутому контуру равен нулю:
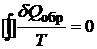
Но если интеграл по замкнутому контуру (т.е. по возвращении системы в исходное состояние) равен нулю, то это означает, что подынтегральное выражение есть полный дифференциал некоторой функции состояния.
2). Эту функцию состояния Р. Клаузиус обозначил буквой 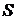 и назвал энтропией («эн» - в, «тропиа» - поворот, превращение). В результате получаем:
и назвал энтропией («эн» - в, «тропиа» - поворот, превращение). В результате получаем:
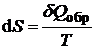
Это и есть выражение 2-го закона термодинамики для обратимых (равновесных) процессов.