Составьте конспект лекции.
Выполненные задания присылать в личном сообщении ВК в виде фото или скринов (не перевернутые). Под своим именем.
Срок сдачи: до 16-00 04.10.2021г
Соединения кислорода, водорода, серы.
Вода. Вода используется в фармации в качестве растворителя и требования к ее качеству достаточно высокие. В настоящее время в медицинской практике и фармации нормировано две формы воды: вода очищенная (ФС 42-2619-97) и вода для инъекций (ФС 42-2620-97). Ранее вода подразделялась на воду дистиллированную и воду для инъекций (ГФ Х). Способы получения воды для инъекций весьма различные, фармакопейная статья на воду очищенную регламентирует методы очистки: дистилляция, ионный обмен, обратный осмос, комбинацию этих способов или иные методы. Требования к качяеству воды отражены в таблице 2.
| Показатель | Вода очищенная ФС 42-2619-97 | Вода для инъекций ФС 42-2620-97 |
| Описание | Бесцветная проз-рачная жидкость без запаха и вкуса | Бесцветная прозрачная жидкость без запаха и вкуса |
| рН (р-р КСl) | 5,0-7,0 | 5,0-7,0 |
| Микробиол. чистота | Не более 100 микроорганизмов в 1 мл | Стерильная |
| Пирогенность | Не регламентируется | Апирогенна |
| Срок хранения | Не ограничен | Не более 24 часов |
При испытании доброкачественности воды ее подвергают проверке на рН, сухой остаток 9 не более 0,001%), восстанавливающие вещества. Восстанавливающие вещества проверяют добавлением перманганата калия в присутствии серной кислоты – должна сохраняться розовая окраска раствора. Диоксид углерода контролируют прибавлением известковой воды. Нитраты и нитриты проверяют с пробой дифениламина. В присутствии нитратов и нитритов дифенил амин окисляется по схеме:
2Ph-NH-Ph→Ph-NH-Ph-Ph-NH-Ph→ в сернокислой среде образуется голубое окрашивание, вызванное появлением хромофора:

Примесь аммиака устанавливают с помощью реактива Несслера (щелочной раствор тетрайодомеркурата (II) калия):

Окраска не должна превышать эталон, содержащий 0.002 мг иона аммония в 1 мл.
Вода очищенная и для инъекций не должна содержать хлориды (по нитрату серебра), сульфаты (по барию хлориду), ионы кальция, тяжелых металлов.
Условия хранения. Используют свежеприготовленной или хранят в закрытых емкостях, изготовленных из материалов, не изменяющих свойства воды и защищающих ее от инородных частиц и микробиологических загрязнений. Воду для инъекций хранят при температуре от 5 до 10 ºC или от 80 до 95ºC не более суток. Исключение составляет лекарственная форма – вода для инъекций в ампулах. Срок хранения этой воды более 2 лет.
Препараты перекиси водорода. По физическим свойствам различают жидкие (3%-ный раствор) и твердые (магния перекись, гидроперит) препараты перекиси водорода. В таблице 3 приведены основные свойства препаратов перекиси водорода:
| Препарат | Химическая формула | Описание | Содержание перекиси |
| Soluto hydrogenii peroxydi diluta –раствор перекиси водорода | Н2О2 | Бесцветная прозрачная жидкость без запаха, кислой реакции | 3% Н2О2 |
| Magnesii peroxydum-магния перекись | МgО2. МgО | Белый легкий порошок, практически нерастворимый в воде | 25% МgО2 |
| Hydroperitum-гидроперит | С(NH2)2О * Н2О2 | Твердое вещество белого цвета, растворимое в воде | 33-35% Н2О2 |
Гидроперит легко разрушается с образованием перекиси водорода при растворении в воде. Магния перекись выделяет перекись водорода при действии минеральных кислот:
MgO2 + 2HCl → MgCl2 + Н2О2
Перенкись водорода впервые получена Тенаром в 1818 году при действии серной кислотой на перекись бария. В настоящее время перекись водорода получают электрохимическим окислением 40-68% растворов серной кислоты при 5-8ºC. Продуктом электролиза является надсерная кислота:

При последующем нагревании раствора в вакууме она разлагается на серную и перекись водорода. Таким путем получают разбавленные растворы перекиси водорода. В вакууме она концентрируется до 30-60% растворов. 96% перекись водорода используют в жидкостных реактивных двигателях в качестве привода насосов окислителя и горючего.
Гидроперит получают взаимодействием перекиси водорода и мочевины в растворе при пониженной температуре. Выпавший осадок отфильтровывают и сушат. Из гидроперита изготавливают таблетки по 1,5 г и 0,75 г.
В химическом отношении перекись водорода представляет собой слабую кислоту. Водные растворы ее имеют слабокислую реакцию, константа диссоциации 1,39.10-12. поэтому пероксиды металлов можно рассматривать как соли перекиси водорода.
Перекись водорода проявляет как окислительные так и восстановительные свойства. Она устойчива в чистом состоянии и в водных растворах (при обычной температуре). Однако присутствие солей тяжелых металлов, диоксида марганца, следов щелочей, окислителей и восстановителей резко ускоряют процесс разложения и могут вызвать взрыв при высокой концентрации растворов:
2 Н2О2 → 2Н2О + О2 ↑ + 188,55 кДж
разложению перекиси водорода способствуют и ферменты – каталаза, перкосидаза, содержащиеся в крови, слюне и других биологических жидкостях. Однако существуют и ряд ингибиторов этой реакции: фосфорная, щавелевая, барбитуровая и мочевая кислота, мочевина, барбитал, ацетанилид. Ингибиторы используют для предотвращения разложения не только концентрированных, но и разбавленных растворов перекиси водорода. Так, ГФ Х рекомендует при приготовлении 35 раствора перекиси водорода прибавлять 0.05% ацетанилида в качестве ингибитора. В гидроперите ингибитором служит мочевина.
Для установления подлинности препаратов перекиси водорода используют реакцию образования окрашенных в синий цвет перекисных соединений (смеси надхромовых кислот и пероксида хрома), растворимых в эфире. К раствору перекиси водорода, подкисленному серной кислотой, прибавляют диэтиловый эфир и несколько капель раствора дихромата калия. После взбалтывания и отстаивания эфирный слой окрашивается в синий цвет:
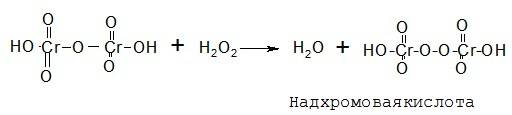
Наряду с надхромовыми кислотами в результате реакции образуется и пероксид хрома:

Для количественной оценки твердых и жидких препаратов перекиси водорода используют либо восстановительные, либо окислительные свойства перекиси водорода.
Количественное определение перекиси водорода по ГФ Х выполняют перманганатометрическим методом в кислой среде:
2KMnO4 + 5H2O2 + 3H2SO4 →2MnSO4 +K2SO4+8H2O +5O
Препарат должен содержать 2,7-3,3% перекиси водорода. Количественное содержание можно установить, используя окислительные свойства перекиси водорода, йодометрическим методом:
2KI + H2O2 + H2SO4 →I2 + K2SO4+2H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Количественное определение магния перекиси проводят перманганатометрическим методом. Определение количества перекиси водорода в таблетках гидроперита – иодометрически.
Хранят 3% раствор перекиси водорода в склянках с притертыми пробками в прохладном, защищенном от света месте.
Natrii thiosulfas – натрия тиосульфат. Na2S2O3 5 H2О.
Свойства. Бесцветные прозрачные кристаллы солоновато-горького вкуса. При 50ºC кристаллы начинают плавиться в свое кристаллизационной воде. Натрия тиосульфат хорошо растворяется в воде, нерастворим в спирте.
Подлинность
На катионы натрия:
1.Окрашивание пламени в желтый цвет;
2.Реакция образования осадка с цинкуранилацетатом.
3.Реакция с пикриновой кислотой (образование осадка пикрата натрия).
Реакции на тиосульфат-анион:
1.При добавлении к раствору тиосульфата натрия соляной кислоты наблюдается помутнение раствора вследствие выделения серы:
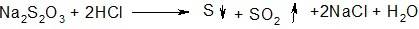
2.При добавлении к раствору тиосульфата натрия избытка раствора азотнокислого серебра образуется белый осадок тиосульфата серебра, который быстро разлагается, осадок при этом желтеет, затем буреет и, наконец, становится черным (образуется сульфид серебра):
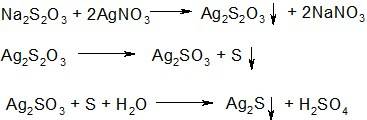
3.При добавлении хлорного железа (III) – фиолетовое, быстроисчезающее окрашивание:

4.С раствором йода обесцвечивание. Тиосульфат натрия окисляется до тетратионата натрия.
Требования к чистоте препарата. Не допускается наличие примесей мышьяка, селена, карбонатов, сульфатов, сульфидов, ионов кальция
Количественное определение. Йодометрический метод. Способ прямого титрования. В качестве индикатора используется крахмал.

Применение в виде инъекционных растворов для лечения аллергических заболеваний. Артритах, невралгиях. Противоядие при отравлении галогенами, цианидами и синильной кислотой (внутрь). Наружно для лечения кожных заболеваний.
Хранение. Тиосульфат натрия содержит кристаллизационную воду, которая легко выветривается, поэтому его следует хранить в прохладном месте в хорошо закупоренных склянках их темного стекла.