ЛР № 16 Принципы действия приборов, регистрирующих атомные эмиссионные спектры
Цель: Ознакомиться с принципом действия приборов контроля компонентов окружающей среды, регистрирующих излучение (эмиссию).
Контролируемые объекты и вещества.
| Приборы и оборудование | Воздух | Вода | Почва |
| Фотометры и спектрофотометры (атомно-эмиссионная спектроскопия) | Щелочные и щелочноземельные металлы | Щелочные и щелочноземельные металлы | Ионы металлов, содержание обменных оснований, подвижные формы микро- и макроэлементов |
| Флуориметры (вторичная эмиссия – флуориметрия) | Смолистые вещества, ароматические соединения, CO, CO2, NO, NO2, N2, SO2, NH3, фреоны, углеводороды бенз(а)пирен, фенолы и др. | Нефть и нефтепродукты, ионы металлов, ароматические соединения, фенолы, ПАВ, ХПК и др. | Нефть и нефтепродукты, валовое содержание Be, подвижная форма В и Zn, соединения редкоземельных элементов, тяжелые металлы, соли уранила, ароматические соединения, лантаноиды и др. |
Принцип действия и основные узлы приборов, регистрирующих атомные эмиссионные спектры
Приборы атомно-эмиссионной спектроскопии (фотометры и спектрофотометры) широко применяются в анализе состава компонентов окружающей среды, при определении различных примесей и загрязнений. Данная группа приборов регистрирует спектры испускания (эмиссионные). Эмиссионные спектры образуются при разложении (дисперсии) квантов света, которые испускает проба в возбужденном состоянии, на отдельные длины волн.
По полученным в результате дисперсии спектрам производят идентификацию вещества (качественный анализ) и определяют его концентрацию в пробе (количественный анализ).
В качестве источников возбуждения могут применяться пламя (t~2000-3000оС), электрическая дуга (t~5000-7000оС), высоковольтная электрическая искра (t~7000-15000оС). Для получения пламени используют газовую горелку, для образования дуги – дуговой генератор либо плазменную горелку или плазмотрон, который представляет собой камеру с двумя графитовыми электродами, между которыми зажигается дуга при силе тока 20-30 А. По трубке, расположенной касательно к стенке подается инертный газ. Температура в плазме достигает 5000-10000оС и выше. Анализируемый раствор подается в плазму специальным распылителем. Для образования искры применяют искровой генератор.
Диспергирующий элемент разлагает излучение в спектр, что определяет разрешающую способность прибора. Под разрешающей способностью прибора эмиссионной спектроскопии понимают его способность давать раздельное изображение двух спектральных линий с близкими длинами волн.
В качестве диспергирующих элементов используют: 1) призму, которую изготавливают из стекла для работы в видимом и ближнем инфракрасном участках спектра и из кварца для работы в ультрафиолетовой области спектра; 2) дифракционную решетку, которая представляет собой стеклянную пластину с нанесенными на нее черными штрихами и имеет широкий спектральный интервал, доступный для исследования (от 200 до 1000 нм).
Приемник света характеризуется спектральной чувствительностью, т.е. способностью воспринимать излучение различной длины волны. Глаз человека чувствителен к свету в области спектра примерно от 400 до 760 нм с максимальной чувствительностью к желто-зеленому свету (550 нм), которая убывает в обе стороны – красной и фиолетовой. Фотопластинка регистрирует спектр в виде фотоснимка с потемнениями разной интенсивности на месте спектральных линий. Фотоэлемент – это устройство, преобразующее световую энергию в электрическую. Усовершенствованной моделью фотоэлемента является фотоумножитель, который усиливает преобразованную электрическую энергию в несколько раз, что повышает чувствительность прибора и облегчает регистрацию аналитического сигнала.
Расшифровка полученных спектров: качественный и количественный анализ содержащихся ингредиентов
После получения спектра анализируемого вещества производят качественный и количественный анализ его компонентов.
Основой качественного (определение состава вещества) эмиссионного спектрального анализа является свойство каждого химического элемента излучать спектр характерной длины волны. Общее число линий в спектре многих элементов очень велико: у тория свыше 2500 линий, у урана – более 5000. Поэтому для целей качественного анализа необходимо установить наличие или отсутствие в спектре так называемых аналитических или последних линий, которые получили свое название потому, что исчезают последними в спектре элемента при уменьшении его концентрации в определяемой пробе. Последние линии хорошо изучены, их длины волн и характеристику интенсивности можно найти в специальных таблицах и атласах спектрального анализа, которые составлены в зависимости от источника возбуждения, в котором получен спектр.
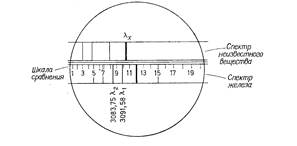
Для определения состава анализируемого вещества его спектр фотографируют обычно над спектром железа (является вторичным стандартом), имеющего в своем составе наибольшее количество характерных линий (рис.2).
|
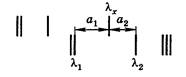
|
Для определения длины волны заданной линии измеряют расстояние а1 от этой линии до ближайшей к ней линии спектра железа, длина волны которой точно известна, и расстояние а2 до другой линии с известной длиной волны (рис. 3).
После этого рассчитывают длину волны по формуле 1.:
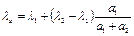 . (формула 1.)
. (формула 1.)
Задача 1. При исследовании эмиссионного спектра анализируемого образца почв была выделена аналитическая линия с неизвестной длиной λх. В целях определения длины волны рассматриваемой линии выбраны две близкорасположенные линии в спектре железа с известными длинами волн: λ1 = 321,0 и λ2 = 322,2 нм. На измерительной шкале микроскопа получены следующие отсчеты: b1 = 9,12 – отметка расположения первой линии в спектре железа, расположенной слева от анализируемой линии, b2 = 10,48 – отметка второй линии в спектре железа, расположенной справа от анализируемой линии, bх = 10,13 мм – отметка анализируемой линии, выделенной в спектре почвенного образца. Какова длина волны искомой линии? Идентифицировать по выделенной линии вещество, входящее в состав образца.
Решение. Так как выбранные линии железа – λ1 и λ2 находятся соответственно слева и справа, для определения длины волны анализируемой линии воспользуемся формулой 1.
1. Предварительно по данным отсчета находим расстояния от линий в спектре железа до определяемой линии – значения а1 и а2: а1 = bх - b1, а2 = b2 - bх
2. Подставляем соответствующие числовые значения в уравнение (формула 1.) и находим значение λх:
По таблице 6 «Наиболее характерные линии в спектре некоторых почв» можно идентифицировать вещество: линия с длиной волны 321,89 нм характерна для группы линий в составе спектра железа.
Количественные показатели элементов, содержащихся в исследуемой пробе, определяют при помощи различных способов. Одним из них является определение по интенсивности спектральных линий. Интенсивность спектральных линий при прочих равных условиях определяется количеством возбужденных атомов в источнике возбуждения, которое зависит не только от концентрации элемента в пробе, но и от условий возбуждения. Связь между интенсивностью спектральной линии и концентрацией элемента в пробе при стабильной работе источника возбуждения устанавливается уравнением:
I = ac, (формула 2.)
где а – коэффициент пропорциональности; с – концентрация вещества.
В зависимости от способов оценки интенсивности различают следующие методы: 1) визуальный; 2) фотографический; 3) фотоэлектрический.
Наиболее распространенным из фотографических методов количественного спектрального анализа является метод трех эталонов. Сущность его заключается в том, что на одной пластинке фотографируют спектры анализируемого образца и трех эталонов, т.е. образцов, содержащих известное количество определяемого элемента, их еще называют стандартными образцами. По спектрам эталонов строят градуировочный график, по которому потом находят значение концентрации вещества в рассматриваемой пробе.
Достаточно широко распространен для количественного анализа также способ одного стандарта или метод сравнения. Сущность его заключается в том, что при одном и том же режиме работе эмиссионного прибора снимают интенсивность свечения аналитических линий стандартного (Iст.) и анализируемого (Iх.) растворов. Затем, подставив в формулу 1.4 указанные величины, получим формулу для расчета концентрации определяемого компонента в зависимости от интенсивности свечения аналитических линий:
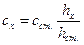 . (формула 3)
. (формула 3)
Задача 2. Для определения натрия в сточных водах был применен метод сравнения. Интенсивность стандартного раствора натрия с концентрацией 5 мг/мл равна 20 условным единицам, а анализируемый раствор имел интенсивность 13 у.е. Определить концентрацию натрия в сточной воде.
Решение. Для решения воспользуемся формулой 3:
Ход работы:
1. Ознакомьтесь с приборами регистрирующих атомные эмиссионные спектры, их основными узлами и принципом действия. Кратко отразите в отчете, зарисуйте рисунки.
2. Опишите расшифровку полученных спектров при проведении качественного и количественного анализа содержащихся ингредиентов. Зарисуйте рисунки
3. Познакомьтесь с примерами интерпретации полученных результатов замеров, решите задачи.
4. Сделайте выводы
МДК 01.01 Приложение к ЛБ 16
Решить задачи:
1) При исследовании почвенного образца был получен эмиссионный спектр. На рис. 3.2 представлено увеличенное изображение участка фотопластинки с заснятым спектром и миллиметровой шкалы, вмонтированной в объектив увеличителя. Определите длину волны неизвестной линии, и идентифицируйте вещество в соответствии с таблицей (табл. 6, приложения) наиболее характерных линий в спектре почв.
2) При исследовании почвенных образцов были выявлены аналитические линии неизвестных веществ.
| Вариант | Длины волн выбранных линий железа, нм | Отсчеты по шкале микроскопа, мм | |||
| λ1 | λ2 | b1 | b2 | bх | |
| 342,410 | 342,700 | 5,08 | 6,14 | 5,62 | |
| 380,122 | 386,511 | 2,06 | 3,18 | 3,06 | |
| 640,012 | 643,099 | 13,36 | 15,23 | 14,17 |
Для определения длины волны выявленных линий были выбраны две близлежащие линии в спектре железа с длинами волн λ1 и λ2, и сняты отсчеты по шкале измерительного микроскопа для этих линий, которые были равны соответственно b1 и b2 (таблица). Определить длину волны заданной линии, если отсчет по шкале для нее равен bх. Идентифицировать аналитические линии по таблице наиболее характерных линий в спектре почв (табл. 1, приложения).
Приложение
Таблица 6 - Наиболее характерные линии в спектре некоторых почв.
| Элемент, соединение | Область спектра, нм | Описание спектральных линий при наблюдении их в почвенном анализе |
| Fe | 215,85–216,00 | Группа из шести близко расположенных линий |
| Fe | 225,95-226,09 | Группа из семи близко расположенных линий |
| Fe | 233,80-234,83 | Группа из пяти линий |
| C | 247,86 | Очень сильная линия углерода |
| Si | 250,69-252,98 | Группа из шести очень интенсивных линий (в почве) и среднеинтенсивных (в растениях) |
| Fe | 259,84-259,96 | Две интенсивные линии |
| Al | 265,25-266,04 | Две интенсивные линии |
| Mg | 277,67-278,30 | Группа из пяти характерных равностоящих линий |
| Mg | 285,21-288,16 | Две очень интенсивные линии |
| Fe | 300,61-302,10 | Характерная группа из пяти линий |
| Al | 308,22-309,27 | Очень интенсивный дублет, причем вторая линия более интенсивная |
| Fe | 309,99-310,07 | Группа из четырех линий, сливающихся в одну сильную |
| Ca | 315,88-318,13 | Три линии |
| Fe | 321,0-322,2 | Очень характерная интенсивная группа линий |
| Na | 330,23 | Очень интенсивная линия в растениях и средней интенсивности в почвах |
| Fe | 330,59-330,73 | Группа из трех линий сливающихся в одну интенсивную линию |
| Fe | 342,50-342,70 | Характерная группа линий |
| CN | 350,0-359,0 380,0-387,0 410,0-420,0 | Три очень темные молекулярные полосы циана |
| Fe | 452,52-453,17 | Группа линий, выделяющихся на бедном линиями участке спектра |
| CaO | 547,30 | Кант молекулярной полосы |
| Fe | 639,35-643,09 | Группа из пяти равностоящих интенсивных линий на бедном линиями участке спектра |