Мышьяк
В лекарственных средствах мышьяк присутствует в виде соединений, в которых его степень окисления равна +3 (арсениты AsO33-) и +5 (арсенаты AsO43-)
а) H3AsO3+3HCl →AsCl3 + 3H2O
AsCl3 + 3H3PO2+3H2O →2As↓ + 3H3PO3+6HCl (коричн)
б)нерастворимый в кислоте хлористоводородной, растворимый в растворе аммиака и в избытке реагента
2AsO2- + 8H+ →2As3++ 4H2O
2As3+ + 3Na2S → As2S3↓ +6Na+(жёлтый)
As2S3 ↓ + 6NH4OH → (NH4)3AsS3 + (NH4)3AsO3 + 3H2O
As2S3↓ + 3Na2S → 2Na3AsS3
в)растворим в кислоте хлористоводородной разведенной (отличие от арсенитов)
Mg2+ + NH4OH + HAsO42- → MgNH4AsO4↓+H2O(белый крист)
Ртуть
а) Cu↓+Hg2+ - Hg↓ +Cu2+
помещают на тщательно очищенную поверхность медной фольги; появляется темно-серое пятно, которое при натирании становится блестящим. Фольгу высушивают и нагревают в пробирке: пятно исчезает
б) Hg2+ + 2OH- → HgO↓ +H2O (жёлт)
в) Hg2++2KI → HgI↓ +2K+ (красный)
HgI2↓+ 2KI→ K2[HgI4](в изб реактива)
.
Реакции подлинности на анионы
Бромиды (Br)
а)Ag++ Br-→ AgBr ↓ (белый)
AgBr ↓ + 2 NH4OH→[Ag(NH3)2]Br+ 2H2O(р-ся в аммиаке)
б)2Br- + PbO2 + 4H+ →Br2 + Pb2+ + 2H2O
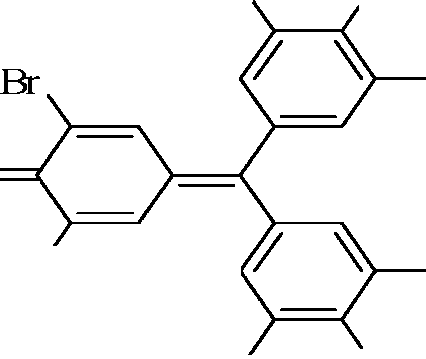
| Br. |
| NH2 |
| H3C |
| Br |
| NH2 |
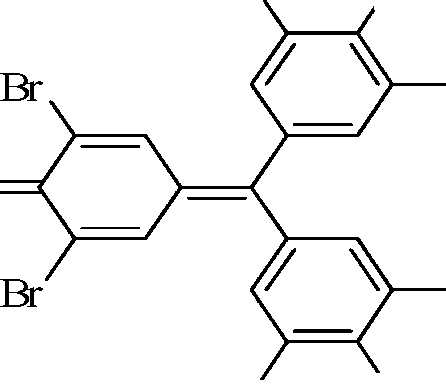
| Br |
| Br |
| NH2 |
О О
в) 2Brˉ + C6H5SO2NNaCl + 2HCl → Br2+ C6H5SO2NH2 + NaCl + 2Clˉ
(в присут-и CHCl3 , окраска хлороформного слоя в жёлт.цвет)
Йодиды
а)Ag+ + I-→ AgI↓
AgI ↓+ NH4OH → не растворяется!
б) 6I- + C2O72- + 14H+ → 3 I2 + 4SO42- + 2Cr3+ + 7H2O
I2 →хлороформ→ красно-фиолетоваяокраска
в) 8I- + SO42- + 10H+ → 4I2 ↑ + 4H2O + H2S ↑ (при t)
Карбонаты и гидрокарбонаты
а)CO32-+ 2H+→ CO2 ↑ + H2O
Ba (OH)2 + CO2 → BaCO3 ↓ + H2O (белый)
BaCO3 ↓ + 2 HCl → CO2 ↑ + H2O (визбыткераств-ся)
б) 4CO32-+ 4MgSO4 + 4H2O → 3MgCO3*Mg(OH)2*3H2O ↓ + 4SO42-+ CO2 ↑ (белый)
|
|
2HCO3- →CO32- + H2O + CO2 ↑ (при t) (гидрокарбонатыприкипяченииобр. осадок)
с) CO32- + фенолфталеин → красное окрашивание (гидрокарбонаты – бесцветные)
Сульфаты
а) Ba++ SO42- →BaSO4 ↓ (белый)
б) сусп из р-ции а) + р-р йода → жёлт. окраска не исчезает(отличие от сульфитов)
Сульфиты
а) HSO3- + H+ → SO2 ↑ +H2O (резкий сернистый запах)
б) 2HSO3- +I2 → 2SO42- + 2I- + 2H+ (об
есцвечивание)
Фосфаты
а) 3Ag+ + PO43-→ Ag3PO4↓ (желтый)
Ag3PO4 ↓ + 6NH4OH→ 3[Ag(NH3)2]3+ + PO43- + 6H2O(раств в аммиаке)
б) PO43-+ молибденованадиевый р-в → (NH4)3PO4*NH4VO3 *16M0O3 (жёлт)
в)H3PO4+12(NH4)2MoO4+21HNO3→ (NH4)3PO4*12 MoO3 ↓ +21NH4NO3+12H2Oжёлт t
(NH4)3PO4* 12 MoO3 ↓ + 23NH4OH →12(NH4)2 MoO4 + (NH4)2HPO4+11H2O
д) Mg2+ + NH4+ + PO43-→ MgNH4PO4 ↓ (белыйкрист)
MgNH4PO4 ↓ + 3HC1 → MgCl2+NH4Cl + H3PO4 (вминкислотах)
Хлориды
а) Ag+ + Cl- → AgCl ↓ (белый творож)
AgCl ↓ + 2NH4OH → [Ag(NH3)2] + + Cl- + 2H2O (в аммиаке)
б) (в 3 этапа) 1) 4Cl- + Cr2O72- + 6H+ → 2CrO2C12 +3H2O
2)
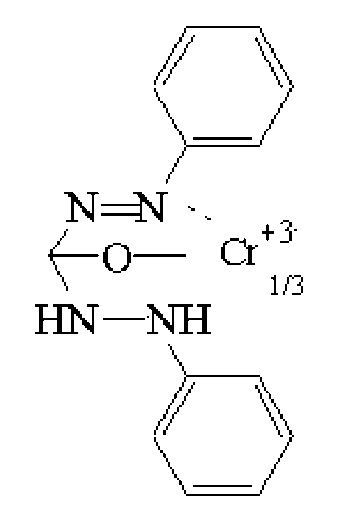
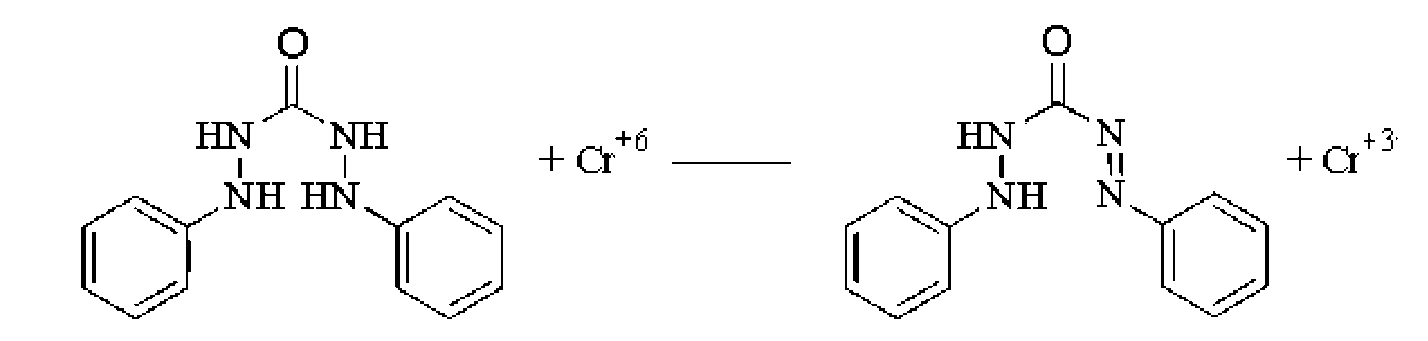
3).фиолетово-красный
Реакции на органические анионы
Ацетаты (CH 3 COO-)
а) CH3COONa+ H2C2O4 → CH3COOH+ NaHC2O4 (запах уксуса)
б)CH3COO- + р-р лантана нитрата + р-р йода + р-р аммиака → t → синий осадок
в) 3CH3COONа + FeCl3 → Fe(CH3COO)3 + 3NaCl (красно-бурое)
3Fe(CHOO)3 + 2H2O → [Fe3(OH)2(CH3COO)6]CH3COO + 2CH3COOH
[Fe3(OH)2(CH3COO)6]CH3COO + 9HCl → 3FeCl3 + 7CH3COOH + 2H2O (вминк-х)
г) CH3COONа + C2H5OH + H2SO4 → CH3COOC2H5 + NaHSO4 +СО2 (запахэтилацетата)
Ацетил
a) (в 2 этапа) 2CH3COO-R + H+→ 2CH3COOH + H-R
CH3COOH + р-рлантананитрата + р-рйода + р-раммиака→ t → синий
Бензоаты
а) ЗС6Н5СОО- + 2Fe3+ + ЗН2О → (СбН5СОО) 3Fe*Fe(ОН) 3 ↓ + 3H+ (в нейтр среде, роз-жёлт, раств в эфире)
б) С6Н5СОО- +H2SO4 + нагревание → на стенках выпад бензойная кислота
в) С6Н5СОО- + HCl→ бенз.к-та↓ (tпл 120-124)
|
|
Лактаты
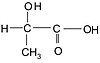 + Br2/H2О → CH3COCOOH → t → НСОН + СН3СНО
+ Br2/H2О → CH3COCOOH → t → НСОН + СН3СНО
СН3СНО +Na2[Fe(CN)5(NO)]→ более интенсивное окрашивание за счет подщелачивания
Салицилаты
а) 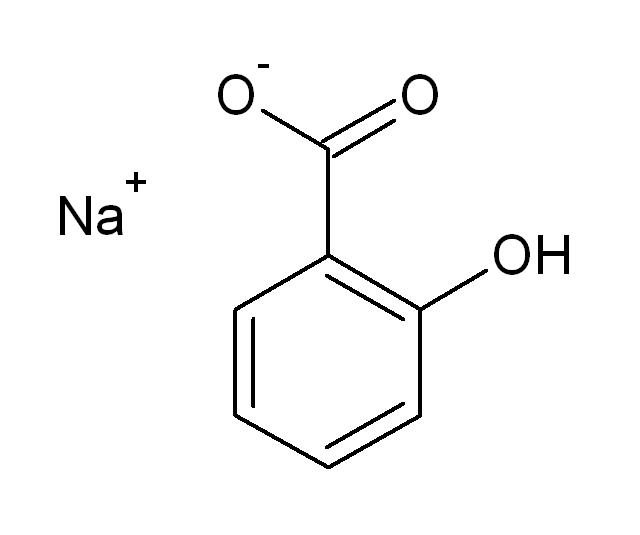 + FeCl3 → фиол. окраш (не исчезает при добукс к-ты, исчез при добHClразведённой,обр. белый крист салициловая к-та)
+ FeCl3 → фиол. окраш (не исчезает при добукс к-ты, исчез при добHClразведённой,обр. белый крист салициловая к-та)
б)  + HCl → белый крист салициловая к-та (tпл 156-161)
+ HCl → белый крист салициловая к-та (tпл 156-161)
Цитраты
А)
СН2СООН CH2СООН
׀ ׀
ОН–С–СООН + MnO4→HCOH+ С=О + t →НСООН +ацетон + 2СО2
׀ ׀
СН2СООН СН2СООН
Б) цитрат натрия + СаСl2→цитрат кальция ↓ +6NaCl (белый, р-ся в НСlразвед.)
В) прибавляют ангидрид уксусный и нагревают; появляется красное окрашивание.