Реакция на алкалоиды
Образец р-т в воде, добавляют хлористоводородн. к-ту до кислой р-ции. +р-в Драгендорфа (р-р калия йодвисмутата)→ оранжевый (оранжево-красный) осадок. Образующееся соединение имеет общую формулу (алкалоид)⁺(BiI₄)⁻
Реакция на барбитураты (за исключением N-замещенных)
| О |
| О |
 Барбитураты, обладая свойствами NH-кислот, вступают в реакции ком-плексообразования с солями тяжелых металлов. Реакцию с солями кобальта используют для установления подлинности всех барбитуратов, кроме тиопентал-натрия. Испытания проводят в спиртовой среде для предотвращения гидролиза комплексной соли с добавлением кальция хлорида, ответственного за формирование фиолетово-синего окрашивания. Центральное место в формирование комплекса занимает ион кобальта, связанный с двумя молекулами барбитуратов, в качестве лигандов выступают молекулы растворителя
Барбитураты, обладая свойствами NH-кислот, вступают в реакции ком-плексообразования с солями тяжелых металлов. Реакцию с солями кобальта используют для установления подлинности всех барбитуратов, кроме тиопентал-натрия. Испытания проводят в спиртовой среде для предотвращения гидролиза комплексной соли с добавлением кальция хлорида, ответственного за формирование фиолетово-синего окрашивания. Центральное место в формирование комплекса занимает ион кобальта, связанный с двумя молекулами барбитуратов, в качестве лигандов выступают молекулы растворителя
Реакция на ксантины
К испытуемому образцу прибавляют р-р пероксида водорода конц. и упаривают на водяной бане до получения сухого желтовато-красного остатка, к кот.прибавляют р-р аммиака разведенного; цвет остатка изменяется на фиолетово-красный (Мурексидная проба) 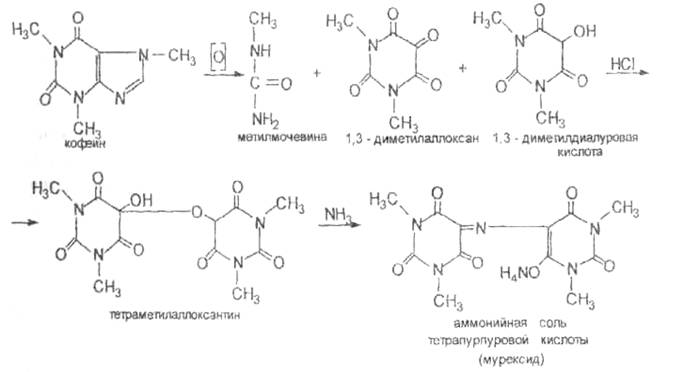
Рекции подлинности на катионы
Алюминий (Al3⁺)
Испытуемый образец р-т в воде, добавляют р-в тиоацетамида, осадок не образуется.Затем прибавляют по каплям раствор натрия гидроксида разведенный, образуется гелеобразный белый осадок, растворяющийся при последующем прибавлении раствора натрия гидроксида разведенного.При добавлении к получ. р-ру аммония хлорида, вновь выпадает гелеобразный осадок
СН3-С-NH2 + Н30 → СН3СОО⁻+ H2S↑+ NH4⁺
׀׀
S
Al3⁺+3OH-→ Al(OH)3↓
Al(OH)3↓+OH-(избыток)→[Al(OH)4]-
[Al(OH)4]-+NH4+→Al(OH)3↓+NH3+H2O.
Аммоний (NH4+)
1) MgO+H2O→ Mg(OH)2
Mg(OH)2+2NH4Cl→MgCl2+2NH3↑+2Н2О
происходит изменения pHсреды и индикатор изменяет свою окраску от красной до желтой
NH3↑ + HCl→ NH4Cl
На 2-й стадии анализа в пробирку, содержащую хлорид аммония, добавляют раствор натрия кобальтинитрита. Происходит образование желтого осадка:
3NH4++[Со(NO2)6 ]3-→(NH4)3[Co(NO2)6]↓
2) NH4++ OH- →NH3↑+H2O
Определяют по специфич. запаху, щелочной реакции (посинение лакмусовой бумажки).
Висмут (Bi3+)
1) Испытуемый образец р-ют в к-те хлористоводородной разведенной, кипятят (образование иона Bi3+).К полученному р-ру прибавляют воду; образуется
белый или светло-желтый осадок, цвет которого после прибавления р-ра натрия сульфида изменяется на коричневый.
Bi3++H2O → BiO++2H+
2BiO++3S2-+2H+ →Bi2S3 ↓ +2OH-
2) При прибавлении раствора тиомочевины к азотнокислым растворам солей висмута появляется желтое или желто-оранжевое окрашивание вследствие образования комплексных ионов:
Bi3++3SC(NH2)2→ [Bi[SC(NH2)2]3]3+
3) При добавлении р-ра калия йодида; образуется чёрный осадок, р-римый в избытке р-ва с образованием р-ра желтовато-оранжевого цвета.
Bi3++3I-→BiI3↓
BiI3+KI→K[BiI4]
Железо (Fe2+) и (Fe3+)
1)Fe2++К++[Fe(CN)6]3- → KFe[Fe(CN)6] ↓
При добавлении раствора калия феррицианида образуется синий осадок, не р-ся при прибавлении кислоты хлористоводородной
2)Fe3++nSCN-→[Fe(SCN)n]3-n
При добавлении р-ра калия тиоционата появляется красное окрашивание. Затем добавляют эфир, встряхивают и оставляют до расслоения;органический слой окрашивается в розовый цвет. При добавлении раствора ртути (II) хлорида красное окрашивание раствора исчезает.
2Fe(SCN)3+ 3Hg2+ → 2Fe3+ + 3Hg(SCN)2
3) Fe3+ + K+ + [Fe(CN)6]4-→KFe[Fe(CN)6] ↓
При добавлении калия ферроцианида образуется синий осадок, не растворяющийся при прибавлении к-ты хлористоводородной.
Калий (К+)
1) Добавляют р-р натрия карбоната и нагревают; осадок не образуется. К горячему раствору прибавляют р-р натрия сульфида; осадок не образуется. Р-р охлаждают, прибавляют кислоты винной и отстаивают; образуется белый кристаллический осадок.
K++H2C4H4O6→ KHC4H4O6↓+H+
Осадок р-ся в горячей воде, сильных кислотах и щелочах, не растворяется в уксусной кислоте
2) При добавлении р-ра натрия кобальтинитрита образуется желтый или оранжево-желтый осадок.
3K++[Co(NO2)6]3-→K3[Co(NO2)6]↓
Осадок не растворим в разбавленных минеральных кислотах, но растворим в концентрированных.
Щелочи разлагают осадок с выделением темно-бурого осадка кобальта гидроксида Co(OH)3.
3) Соль калия внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло в пурпурно-красный цвет.
Кальций (Ca2+)
1) К образцу добавляютр-р гексацианоферрата (II) калия; р-р остается прозрачным. Затем добавляют аммония хлорида; образуется белый кристаллический осадок.
Ca2++2NH4++[Fe(CN)6]4-→(NH2)2Ca[Fe(CN)6] ↓
Осадок растворяется в минеральных кислотах, но нерастворим в уксусной кислоте.
2) При добавлении аммония оксалата образуется белый осадок, нер-римый в к-те уксусной разведенной и растворе аммиака, р-римый в разведенных минеральных кислотах.
Ca2+ + (NH4)C2O4→CaC2O4↓+2NH4+
3) Соль кальция, смоченная кислотой хлористоводородной и внесенная в бесцветное пламя, окрашивает его в оранжево-красный цвет.
Магний (Mg2+)
При добавлении р-ра аммиака разведенного образуется белый осадок, р-щийся при прибавлении р-ра аммония хлорида. К полученному р-ру прибавляют р-радинатриягидрофосфата образуется белый кристаллический осадок.
Mg2++2NH4OH → Mg(OH)2↓+2NH4+Mg(OH)2↓+HPO42-+NH3 →MgNH4PO4↓+2OH-
Натрий (Na+)
Классическим реактивом для качественного и количественного определения ионов натрия является уранил ацетат, который в присутствии ионов натрия и двухвалентных металлов (Mg, Zn, Co, Ni и др.) дает осадки состава NaMe2+(UO2)3(CH3COO)9 однако из-за высокой токсичности и радиоактивности данного реактива реакция не находит применения в практике.
1) Добавляюткалия пироантимоната и нагревают до кипения, затем охлаждают в ледяной воде и потирают внутренние стенки пробирки стеклянной палочкой; образуется плотный осадок белого цвета:
Na++K[Sb(OH)6] → Na[Sb(OH)6] ↓+K+
2) При добавленииметоксифенилуксусной к-ты реактива образуется объемный белый кристаллический осадок, р-ся при добавлении р-ра аммиака разведенного.
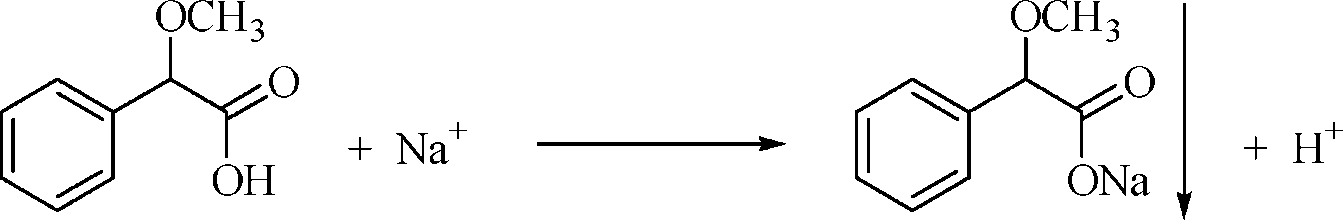
3) Соль натрия, смоченная кислотой хлористоводородной и внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Свинец (Pb2+)
1)При добавлении р-ра калия хромата образуется желтый осадок, растворяющийся в р-ре натрия гидроксида конц.:
Pb2++CrO42-→ PbCrO41
Pb CrO4↓+4OH- → [Pb(OH)4]2-+CrO42-
2) При добавлении р-ра калия йодида образуется желтый осадок
Pb2++2I-→ РbI2↓
Серебро (Ag+)
1) Прибавляют к-ты хлористоводородной, образуется белый творожистый осадок, р-ся в р-ре аммиака разведенного.
Ag++Cl-→AgCl↓
AgCl↓+ 2NH4OH→ [Ag(NH3)2]++2H2O
2)Прибавляют раствор аммиака разведенного до растворения образующегося вначале осадка, затем р-р формальдегида и нагревают; на стенках пробирки образуется блестящий налет металлического серебра.
Ag++ 2NH3→ [Ag(NH3)2]+
[Ag(NH3)2]++HCOH→ Ag↓+HCOO-+2NH3↑
Сурьма (Sb3+ и Sb5+)
Прибавляют р-р натрия сульфида образуется оранжево-красный осадок, р-ся при прибавлении р-ра натрия гидроксида разведенного.
2Sb3++3Nа2S → Sb2S3↓ +6Na+
2Sb2S3↓+4OH- → SbO2-+3SbS2-+4S2-+2H2O
Цинк (Zn2+)
Zn2++2OH-→ Zn(OH)2↓
добавляют р-р натрия гидроксида концентрированного образуется белый осадок
Zn(OH)2↓+2OH-→ [Zn(OH)4]2- осадок растворяется
[Zn(OH)4] 2-+4NH4Cl→ [Zn(NH3)4] 2++4Cl-+4OH- р-р прозрачный
[Zn(NH3)4] 2++S2-→ ZnS↓+4NH3 белый хлопьевидный осадок