Задание
1. Конспект «Алкадиены»
2. ПР № 4
Сопряжённые алкадиены
Цель: изучить строение, способы получения, химические свойства алкадиенов
План лекции
1. Строение алкадиенов
2. Способы получения
3. Химические свойства
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnH2n-2.
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах:
1) изолированные двойные связи разделены в цепи двумя или более s-связями - СН2=СН–СН2–СН=СН2 (разделенные sp3 -атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах);
2) кумулированные двойные связи расположены у одного атома углерода - СН2=С=СН2 (подобные диены (аллены) менее стабильны, чем другие диены и при нагревании в щелочной среде перегруппировываются в алкины);
3) сопряжённые двойные связи разделены одной s-связью - СН2=СН–СН=СН2. Сопряжённые диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp2 -атомов углерода. Все атомы углерода лежат в одной плоскости, образуя s-скелет. Негибридизованные р-орбитали каждого атома углерода перпендикулярны плоскости s-скелета и параллельны друг другу, взаимно перекрываются, образуя единое p-электронное облако. Такой особый вид взаимного влияния атомов называется сопряжением.
Изображение молекулы бутадиена – 1,3 (вид «сверху») (р–орбитали – в виде окружностей)
|
|

Перекрывание р-орбиталей имеет место не только между С1 – С2, С3 – С4, но и между С2 – С3. В связи с этим применяют термин: «сопряжённая система». Следствием делокализации электронной плотности является то, что длины связей С1 – С2 (С3 – С4) увеличены, по сравнению с длиной двойной связи в этилене (0,132 нм) и составляют 0,137 нм; в свою очередь, длина связи С3 – С4 меньше, чем в этане С – С (0,154 нм) и составляет 0,146 нм. Диены с сопряжённой системой двойных связей более энергетически выгодны.
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода) с добавлением окончания – диен.
Виды изомерии:
1) структурная изомерия;
2) изомерия положения сопряжённых двойных связей;
3) изомерия углеродного скелета;
4) пространственная изомерия (диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию).
Способы получения
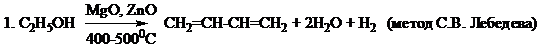
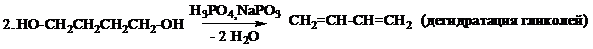
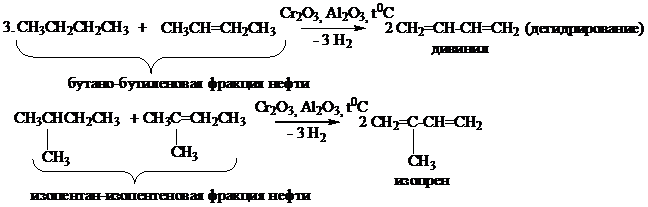
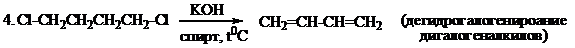
Химические свойства
Для сопряжённых диенов характерны реакции присоединения. Наличие сопряжённой системы p-электронов приводит к особенностям реакций присоединения. Сопряжённые диены способны присоединять не только по двойным связям (С1 и С2, С3 и С4), но и к концевым (С1 и С4) атомам углерода сообразованием двойной связи между С2 и С3.
1. CH2=CH-CH=CH2 + Br2®CH2Br-CH=CH-CH2Br + CH2Br-CHBr-CH=CH2 (присоединение гало- генов) 1,4- присоединение 1,2- присоединение
|
|
Соотношение продуктов 1,2- и 1,4-присоединения зависит от температуры, при которой проводился эксперимент и от полярности применяемого растворителя.
2. CH2=CH-CH=CH2 + HBr®CH3-CH=CH-CH2Br + CH3-CHBr-CH=CH2 (присоединение галогеноводородов) 1,4- присоединение1,2- присоединение
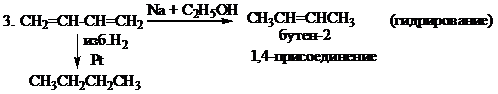
Восстановление с помощью [Na + C2H5OH] называется восстановлением водородом в момент выделения (при взаимодействии натрия и спирта выделяется водород). Алкены в таких условиях не восстанавливаются, это отличительное свойство сопряжённых диенов.
3. n CH2=CH-CH=CH2  (-CH2-CH=CH-CH2-)n (полимеризация)
(-CH2-CH=CH-CH2-)n (полимеризация)
Полимеризация - важнейшее свойство сопряжённых диенов, которая происходит под действием различных катализаторов (AlCl3, TiCl4+(C2H5)3Al) или света. В случае применения определённых катализаторов можно получить продукт полимеризации с определённой конфигурацией цепей.
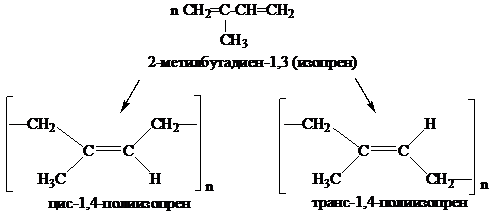
Цис-конфигурацию имеет натуральный каучук. Макромолекулы натурального каучука имеют спиралевидную структуру цепи из-за того, что изопреновые звенья изогнуты, что создаёт пространственные препятствия упорядоченному расположению цепей. В каучуке длинные молекулы скручены и спутаны друг с другом в спирали. При растяжении каучука спирали растягиваются, а при снятии напряжения они снова скручиваются. В природе существует ещё другой полимер изопрена гуттаперча (транс-конфигурация). Гуттаперча обладает стержнеобразной структурой цепи из-за выпрямленностиизопреновых звеньев (цепи с транс-конфигурацией двойных связей могут располагаться одна вдоль другой), поэтому гуттаперча твёрдый, но хрупкий полимер. Натуральный каучук имеют немногие страны и поэтому его заменяют синтетическими каучуками из дивинила, а также из изопрена.
|
|
Практическая работа № 4
Изомерия, генетическая связь алкадиенов, алкинов
Цель: закрепить теоретические знания о изомерии, химических свойствах алкадиенов, алкинов.
Методические указания
Алкадиены – это непредельные углеводороды с двумя двойными связями. Виды изомерии алкадиенов: структурная (разветвление углеродной цепочки, разное положение двух двойных связей), межклассовая с алкинами. Для алкадиенов характерны реакции присоединения, полимеризации, горения.
Алкины – это непредельные углеводороды с одной тройной связью. Виды изомерии алкинов: структурная (разветвление углеродной цепочки, разное положение тройной связи), межклассовая с алкадиенами. Для алкинов характерны реакции присоединения, полимеризации, горения.
Пример 1: составить структурные формулы изомеров для вещества состава С5Н8 и назвать их по систематической номенклатуре.
1) СН2=С=СН-СН2-СН3 пентадиен-1 2) СН2=СН-СН=СН-СН3 пентадиен-1,3
3) СН2=СН-СН2-СН=СН2 пентадиен-1,4 4) СН≡С-СН2-СН2-СН3 пентин-1
5) СН3-С≡С-СН2-СН3 пентин-2 6) СН≡С-СН-СН3 3-метилбутин-1
|
СН3
7) СН2=С-СН=СН2 2-метилбутадиен-1,3
|
СН3
Пример 2: осуществить превращения:
СН4 → С2Н2 → С2Н6 → С4Н10 → С4Н6
1. 2СН4 → С2Н2 + 3Н2
2. С2Н2 + 2Н2 → С2Н6
3. С2Н6 + Cl2 → C2H5Cl + HCl 2C2H5Cl + 2Na → C4H10 + 2NaCl
4. С4Н10 → С4Н6 + 2Н2