Полагая, что измеренное значение  соответствует буферной смеси с максимальной буферной емкостью, определить
соответствует буферной смеси с максимальной буферной емкостью, определить  по уравнениям (2.36) или (2.41). Сопоставить рассчитанное значение
по уравнениям (2.36) или (2.41). Сопоставить рассчитанное значение  со справочной величиной. Для этого построить графики зависимости
со справочной величиной. Для этого построить графики зависимости  от
от  . Экстраполяция на нулевую ионную силу может быть нелинейной, что связано с наличием сил взаимодействия между ионами, а также ионов с молекулами растворителя
. Экстраполяция на нулевую ионную силу может быть нелинейной, что связано с наличием сил взаимодействия между ионами, а также ионов с молекулами растворителя
Отчет включает в себя следующие разделы: теоретическую часть, цель работы, схему установки, описание методики измерения, табл. 2.4, включающую расчеты по составлению заданных буферных смесей, результаты параллельных измерений величины  . По графикам зависимости
. По графикам зависимости  от
от  для каждой серии замеров определяют
для каждой серии замеров определяют  , затем, в соответствии с разделом 1 «Определение параметра по результатам прямых измерений» определяют среднее значение и диапазона, внутри которого, с вероятностью 95%, находится математическое ожидание
, затем, в соответствии с разделом 1 «Определение параметра по результатам прямых измерений» определяют среднее значение и диапазона, внутри которого, с вероятностью 95%, находится математическое ожидание  . Далее проводят статистическое сравнение со справочной величиной (приложение, табл. 3).
. Далее проводят статистическое сравнение со справочной величиной (приложение, табл. 3).
Таблица 2.4
Составы буферных смесей с максимальной буферной емкостью
и переменной ионной силой;  ,
,  . [1]
. [1]
| № п/п |  ,
моль/л ,
моль/л
| Объем,  , мл , мл
| 
| Ионная сила, моль/л | ||
3. НЕРАВНОВЕСНЫЕ ЯВЛЕНИЯ
В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Участниками электрохимических реакций являются электроны, ионы и нейтральные частицы. Перенос участников реакций происходит по механизму миграции, диффузии, конвекции и термодиффузии. Перенос участников реакции под действием электрического тока (миграция) отличает электрохимические системы от систем с химическими реакциями.
Движение ионов в проводниках второго рода (растворы электролитов) и электронов в проводниках первого рода (металлы) под влиянием градиента потенциала или напряженности электрического поля обусловливает их способность пропускать электрический ток, то есть их электропроводность.
Для растворов электролитов, как и для проводников первого рода, справедлив закон Ома:
 , (3.1)
, (3.1)
где 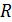 – сопротивление, Ом;
– сопротивление, Ом; 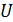 – напряжение, В;
– напряжение, В;  – ток в цепи, А.
– ток в цепи, А.
Для количественной характеристики способности растворов электролитов проводить ток используют следующие величины электропроводности: удельная, эквивалентная и молярная.
Удельная электропроводность ( ) – электропроводность куба раствора с длиной ребра 1 м и электродами расположенными на противоположных гранях куба. Размерность этой величины См·м-1:
) – электропроводность куба раствора с длиной ребра 1 м и электродами расположенными на противоположных гранях куба. Размерность этой величины См·м-1:
 , (3.2)
, (3.2)
где  – удельное сопротивление.
– удельное сопротивление.
Для определения удельной электропроводности измеряют сопротивление электрохимической ячейки (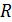 ), в которой находится исследуемый раствор, с помощью постоянного или переменного тока:
), в которой находится исследуемый раствор, с помощью постоянного или переменного тока:
 , (3.3)
, (3.3)
где  – расстояние между электродами;
– расстояние между электродами;  – поперечное сечение слоя электролита между электродами.
– поперечное сечение слоя электролита между электродами.
При измерении удельной электропроводности растворов электролитов отношение величин  зависит от конструкции ячейки, его называют постоянной ячейки, м-1:
зависит от конструкции ячейки, его называют постоянной ячейки, м-1:
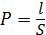 . (3.4)
. (3.4)
Для определения постоянной ячейки измеряют сопротивление стандартного раствора, как правило, раствора хлорида калия, с известной удельной электропроводностью
 , (3.5)
, (3.5)
где  – удельная электропроводность и
– удельная электропроводность и  – сопротивление стандартного раствора.
– сопротивление стандартного раствора.
Молярная электропроводность  – это проводимость раствора электролита, находящегося между двумя параллельными плоскостями, расположенными на расстоянии 1 м друг от друга и такой площади, чтобы между ними находился один моль растворенного вещества. Молярная электропроводность может быть рассчитана как отношение удельной электропроводности к молярной (
– это проводимость раствора электролита, находящегося между двумя параллельными плоскостями, расположенными на расстоянии 1 м друг от друга и такой площади, чтобы между ними находился один моль растворенного вещества. Молярная электропроводность может быть рассчитана как отношение удельной электропроводности к молярной (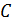 , моль/м3) концентрации растворенного вещества, См·м2/моль:
, моль/м3) концентрации растворенного вещества, См·м2/моль:
 . (3.6)
. (3.6)
Отношение удельной электропроводности к концентрации, выраженной в молярных эквивалентах  называют эквивалентной электропроводностью, См·м2/(моль·экв):
называют эквивалентной электропроводностью, См·м2/(моль·экв):
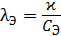 , (3.7)
, (3.7)
Разные формы выражения концентраций связаны между собой:
 ,
,
поэтому эквивалентная электропроводность может быть рассчитана с использованием молярной концентрации:
 , (3.8)
, (3.8)
где  – заряд катиона;
– заряд катиона;  – стехиометрический коэффициент катиона.
– стехиометрический коэффициент катиона.
Эквивалентная электропроводность раствора электролита складывается из ионных электропроводностей или подвижностей отдельных ионов  :
:
 . (3.9)
. (3.9)
Ионная электропроводность 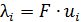 определяется электрической подвижностью иона
определяется электрической подвижностью иона  (абсолютной скоростью движения иона). При бесконечном разведении, когда
(абсолютной скоростью движения иона). При бесконечном разведении, когда  , электропроводность раствора равна сумме предельных электропроводностей или предельных подвижностей ионов
, электропроводность раствора равна сумме предельных электропроводностей или предельных подвижностей ионов  (закон независимого движения ионов Кольрауша).
(закон независимого движения ионов Кольрауша).
Важным параметром, характеризующим процесс миграции, являются числа переноса ионов. Число переноса – это доля тока, которую переносит данный сорт ионов:
 . (3.10)
. (3.10)
Сумма чисел переноса всех видов ионов равна единице 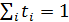 .
.