Определяют удельную электропроводности исследуемого раствора, используя мост переменного тока (рис. 3.2), а затем рассчитывают растворимость по уравнению (3.18). При подсчетах растворимости солей типа  сначала используют значения
сначала используют значения 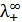 и
и 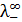 при бесконечном разведении. Затем, после нахождения приблизительного значения растворимости
при бесконечном разведении. Затем, после нахождения приблизительного значения растворимости 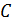 , эту величину уточняют, интерполируя и используя, если это возможно, значения
, эту величину уточняют, интерполируя и используя, если это возможно, значения 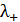 и
и 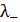 при соответствующих концентрациях.
при соответствующих концентрациях.
Отчет включает в себя следующие разделы: теоретическую часть, цель работы, схему установки, описание методики измерения, таблицу результатов измерений, расчет растворимости соли и сравнение со справочными данными. Значения электропроводности усредняют, а величину ошибки рассчитывают, как описано в разделе статистической обработки данных прямых измерений. Следует учесть, что  . Из полученных дисперсий измерений электропроводности раствора и воды, определяют среднеквадратическую ошибку электропроводности соли, а затем ошибку в определении концентрации.
. Из полученных дисперсий измерений электропроводности раствора и воды, определяют среднеквадратическую ошибку электропроводности соли, а затем ошибку в определении концентрации.
Лабораторная работа № 8.
Определение чисел переноса методом Гитторфа
В переносе электричества через электролиты участвуют все ионы, однако доля их участия различна. Поэтому вводят понятие чисел переноса 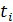 . Число переноса показывает долю участия данного сорта ионов в переносе электричества через раствор:
. Число переноса показывает долю участия данного сорта ионов в переносе электричества через раствор:
 . (3.19)
. (3.19)
Здесь  – общий ток,
– общий ток, 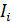 – ток, переносимый i -ым сортом ионов. Очевидно, сумма чисел переноса всех ионов, присутствующих в растворе, равна единице, т. е.
– ток, переносимый i -ым сортом ионов. Очевидно, сумма чисел переноса всех ионов, присутствующих в растворе, равна единице, т. е.  .
.
Числа переноса связаны со скоростями движения соответствующих ионов  ,
, 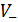 и ионными подвижностями
и ионными подвижностями 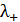 ,
, 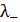 следующими соотношениями:
следующими соотношениями:
 ;
; 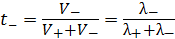 . (3.20)
. (3.20)
Для смесей электролитов число переноса каждого иона зависит также от его концентрации в растворе:
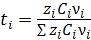 . (3.21)
. (3.21)
В первое время после начала электролиза концентрационные изменения в приэлектродных слоях раствора целиком определяются количеством пропущенного электричества.
Рассмотрим электрохимическую систему, состоящую из двух медных электродов, опущенных в раствор сульфата меди.
Система 
катод анод
Составим электродный баланс:
| Катодное пространство | Анодное пространство |
Разряд  Перенос
Перенос 
| 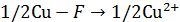

|
| После суммирования: | |



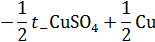
| 

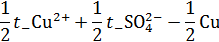

|
В результате прохождения через систему 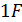 электричества
электричества  молей сульфата меди переносится из катодного в анодное пространство. Если известно количество электричества (
молей сульфата меди переносится из катодного в анодное пространство. Если известно количество электричества ( , Кл), которое пропущено через систему, то число переноса аниона можно посчитать по уравнению:
, Кл), которое пропущено через систему, то число переноса аниона можно посчитать по уравнению:
 . (3.22)
. (3.22)
Число перенесенных молей сульфата меди можно определить по изменению концентрации соли в катодном (уменьшение) и анодном (увеличение) пространствах. Измерительная ячейка (рис. 3.3) представляет собой сосуд с разделенными катодным (1), анодным (3) и средним (2) пространствами.

Рисунок 3.3. Ячейка для измерения чисел переноса методом Гитторфа:
1, 2, 3 – трубки с кранами для сливания раствора; 4 – краны, позволяющие разделять электролит; 5 и 6 – медненые платиновые электроды площадью примерно 1 см2
Для системы 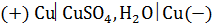 изменения количества молей соли в католите
изменения количества молей соли в католите  и анолите
и анолите  будут равны между собой по абсолютной величине и пропорциональны количеству электричества
будут равны между собой по абсолютной величине и пропорциональны количеству электричества  (или числу фарадеевских констант
(или числу фарадеевских констант  ), пропущенного через ячейку, т. е.
), пропущенного через ячейку, т. е.
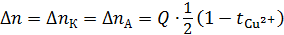 , моль-экв. (3.23)
, моль-экв. (3.23)
 . (3.24)
. (3.24)
Здесь  ,
, 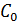 и
и  концентрации сульфата меди, соответственно, в катодном, среднем и анодном пространствах измерительной ячейки;
концентрации сульфата меди, соответственно, в катодном, среднем и анодном пространствах измерительной ячейки; 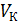 и
и  – объемы электролита катодного и анодного пространства ячейки.
– объемы электролита катодного и анодного пространства ячейки.
Окончательно уравнение для расчета чисел переноса имеет вид
 . (3.25)
. (3.25)
где 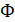 – число фарадеевских констант, пропущенных через ячейку.
– число фарадеевских констант, пропущенных через ячейку.
Методом Гитторфа определяют кажущиеся числа переноса, так как ионы  и
и 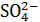 в действительности гидратированы и переносят с собой воду, что не было учтено в приведенных выше расчетах.
в действительности гидратированы и переносят с собой воду, что не было учтено в приведенных выше расчетах.
Цель работы – определение чисел переноса ионов  и
и 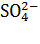 в растворе сульфата меди.
в растворе сульфата меди.
Возможны другие варианты заданий.
1) определить числа переноса в зависимости от концентрации электролита;
2) исследовать влияние посторонних электролитов на числа переноса.
Экспериментальная часть
Измерение проводят с помощью ячейки (сосуда), позволяющей разделить католит, анолит и среднее пространство. В крайние трубки помещают медные электроды площадью около 1 см2. Кроме того, трубка имеет два крана, позволяющих разделить объем электролизера на три части (рис. 3.3). Электролитом служит 0,25-0,5 моль-экв/л раствор сульфата меди. Собирают электрическую схему, состоящую из включенных последовательно ячейки для измерения чисел переноса, медного кулонометра и амперметра (рис. 3.4). Перед началом опыта тщательно промытую ячейку (сосуд) заливают электролитом. Катод медного кулонометра, который используется для определения количества пропущенного электричества, взвешивают. После этого устанавливают все электроды и включают ток силой 10-15 мА. Не следует вести электролиз при очень большой силе тока, так как это приводит к нагреванию электролита и усилению конвекционного перемешивания.
После окончания опыта закрывают верхние краны (чтобы не допустить перемешивания электролита) и отключают ток, растворы из катодного, анодного и среднего пространства сливают в отдельные стаканы, измеряют их объём и титруют медь иодометрическим способом. Одновременно катод кулонометра промывают, высушивают и взвешивают.
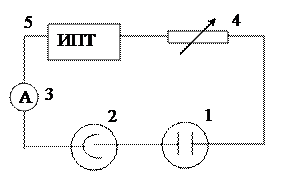
Рис. 3.4. Электрическая схема установки
для определения чисел переноса методом Гитторфа:
1 – ячейка; 2 – медный кулонометр; 3 – амперметр;
4 – реостат; 5 – источник постоянного тока
Для получения точных результатов по методу Гитторфа необходимо, чтобы на границе фаз электроды – электролит при пропускании тока не протекали побочные процессы (разряд молекул растворителя, совместный разряд ионов и т. п.). Время пропускания тока должно быть по возможности коротким, чтобы пренебречь вероятными изменениями концентрации в среднем пространстве сосуда.
 Для того чтобы убедиться, что электролиз прерван прежде, чем изменилась концентрация раствора в средней части, исходный электролит титруют до начала опыта. Концентрация меди в среднем пространстве и в исходном электролите должна в пределах точности определения совпадать.
Для того чтобы убедиться, что электролиз прерван прежде, чем изменилась концентрация раствора в средней части, исходный электролит титруют до начала опыта. Концентрация меди в среднем пространстве и в исходном электролите должна в пределах точности определения совпадать.