Содержание лекции
1. Алкены, или олефины (от лат. olefiant - масло — старое название, но широко используемое в химической литературе. Поводом к такому названию послужилхлористый этилен, полученный в XVIII столетии, — жидкое маслянист вещество.) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь.
Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
Алкены образуют гомологический ряд с общей формулой CnH2n
Гомологический ряд алкенов
| СnH2n (алкен) | Названия, суффикс ЕН, ИЛЕН | |
| C2Н4 | этен, этилен | СH2=CH2 |
| C3H6 | пропен | СH2=CH-CH3 |
| C4H8 | бутен | СH2=CH-CH2-CH3 |
| C5H10 | пентен | СH2=CH-CH2-CH2-СН3 |
| C6H12 | гексен | СH2=CH-CH2-CH2- CH2-СН3 |
Простейшим алкеном является этилен - C2H4
Структурная и электронная формулы этилена имеют вид:
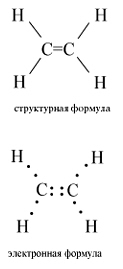
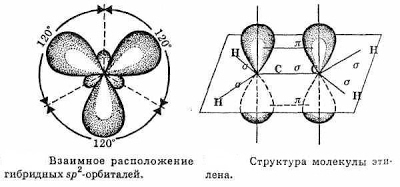
В молекуле этилена подвергаются гибридизации одна s - и две p -орбитали атомов C (sp 2-гибридизация).
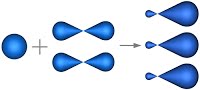
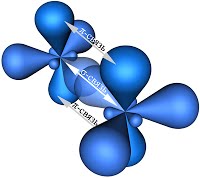
Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p -орбитали. Две из гибридных орбиталей атомов углерода взаимно перекрываются и образуют между атомами углерода σ - связь. Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с четырьмя s -орбиталями атомов H и также образуют четыре σ-связи. Две негибридные p -орбитали атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости σ - связь, т.е. образуется одна p- связь.
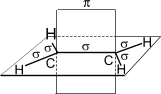
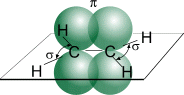
По своей природе p-связь резко отличается от σ - связь; p-связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Под действием реагентов p-связь легко разрывается. Молекула этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм. Если атомы соединены двойной связью, то их вращение невозможно без того, чтобы электронные облака p- связь не разомкнулись.
Изомерия алкенов
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8):
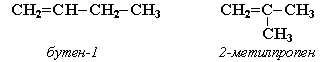
2. Изомерия положения двойной связи (начиная с С4Н8):

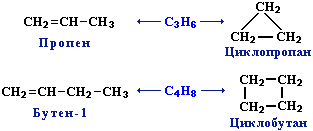
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:
Пространственная изомерия алкенов
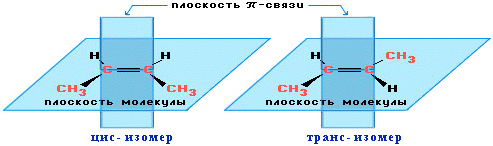
Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения p-связи (p-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис - транс -изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости p-связи. Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис -изомере, либо по разные стороны в транс -изомере.
 ,
,
Изомеры цис - и транс - отличаются не только физическими, но и химическими свойствами, т.к. сближение или удаление частей молекулы друг от друга в пространстве способствует или препятствует химическому взаимодействию.
Номенклатура
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен: этан — этилен, пропан — пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:
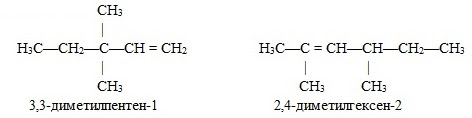
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
(Н2С=СН—) винил или этенил
(Н2С=CН—СН2) аллил
Физические свойства
Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.), легче воды, с увеличением Mr температуры плавления и кипения увеличиваются. Физические свойства некоторых алкенов показаны в табл. 1.
Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) — газы, начиная с C5H10(амилен, или пентен-1) — жидкости, а с С18Н36 — твердые вещества. С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение. Температуры кипения цис-изомеров выше, чем транс-изомеров, а температуры плавления — наоборот. Алкены плохо растворимы в воде (однако лучше, чем соответствующие алканы), но хорошо — в органических растворителях. Этилен и пропилен горят коптящим пламенем.
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
Таблица 1. Физические свойства некоторых алкенов
| Название | Формула | t пл,°С | t кип,°С |
| Этилен (этен) | С2Н4 | -169,1 | -103,7 |
| Пропилен (пропен) | С3Н6 | -187,6 | -47,7 |
| Бутилен (бутен-1) | C4H8 | -185,3 | -6,3 |
| Цис-бутен-2 | С4Н8 | -138,9 | 3,7 |
| Транс-бутен-2 | С4Н8 | -105,5 | 0,9 |
| Изобутилен (2-метилпропен) | С4Н8 | -140,4 | -7,0 |
| Амилен (пентен-1) | C5H10 | -165,2 | +30,1 |
| Гексилен (гексен-1) | С6Н12 | -139,8 | 63,5 |
| Гептилен (гептен-1) | C7H14 | -119 | 93,6 |
| Октилен (октен-1) | C8H16 | -101,7 | 121,3 |
| Нонилен (нонен-1) | C9H18 | -81,4 | 146,8 |
| Децилен (децен-1) | С10Н20 | -66,3 | 170,6 |