Для алкенов наиболее типичными являются реакции присоединения. В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции присоединения.
Реакции присоединения
1. Гидрирование (гидрогенизация – взаимодействие с водородом):
CnH2n + H2 t, Ni → CnH2n+2
2. Галогенирование (взаимодействие с галогенами):
CnH2n + Г2 → СnH2nГ2
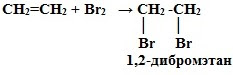
Это качественная реакция алкенов – бромная вода Br2 (бурая жидкость) обесцвечивается.
3. Гидрогалогенирование* (взаимодействие с галогенводородами):
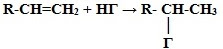
4. Гидратация* (присоединение молекул воды):
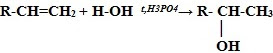
CH2=CH2 + H2O t,H3PO4→ CH3-CH2-OH (этанол – этиловый спирт)
* Присоединение галогенводородов и воды к несимметричным алкенам происходит по правилу Марковникова В.В.
Присоединение водорода происходит к наиболее гидрированному атому углерода при двойной углерод-углеродной связи.
5. Реакции полимеризации:
nCH2=CH2 t, p, kat-TiCl4, Al(C2H5)3 → (-CH2-CH2-)n
мономер - этилен полимер – полиэтилен
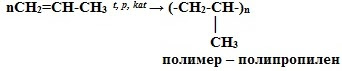
Реакции окисления
1. Горение:
CnH2n + 3n/2O2 t, p, kat → nCO2 + nH2O + Q (пламя ярко светящее)
Частичное окисление этилена

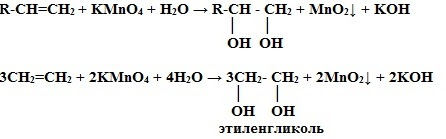
2. Окисление перманганатом калия (р. Вагнера) в нейтральной среде– это качественная реакция алкенов, розовый раствор марганцовки обесцвечивается.
Способы получения алкенов
Получение в промышленности
| 1. Крекинг алканов: Основным промышленным источником получения первых четырех членов ряда алкенов (этилена, пропилена, бутиленов и пентиленов) являются газы крекинга и пиролиза нефтепродуктов, а также газы коксования угля (этилен, пропилен). Газы крекинга и пиролиза нефтепродуктов содержат от 15 до 30% олефинов. Так, крекинг бутана при 600°С приводит к смеси водорода, метана, этана и олефинов – этилена, пропилена, псевдобутилена (бутена-2) с соотношением олефинов ≈ 3,5: 5: 1,5 соответственно. CnH2n+2 t, (400-700) → CnH2n+2 + CnH2n алкан алкен |
| 2. Дегидрирование алканов: CnH2n+2 t, kat-Ni или (Cr2O3)→ CnH2n +H2 |
| 3. Гидрирование алкинов: CnH2n-2 + H2 t, kat-(Pt или Pd, Ni) → CnH2n |
Получение в лаборатории
1. Дегидратация* спиртов:
R-CH2-CH2-OH t>140°C, H2SO4(конц.)→ R-CH=CH2 + H2O
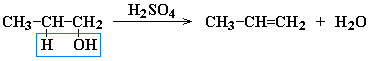
|
2. Дегидрогенирование* моногалогеналканов (по правилу Зайцева):
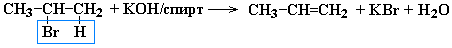 *Правило А. М. Зайцева: Отрыв атома водорода происходит от наименее гидрогенизированного атома углерода.
*Правило А. М. Зайцева: Отрыв атома водорода происходит от наименее гидрогенизированного атома углерода.
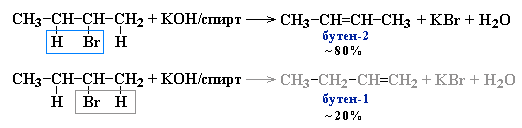
|
3. Дегалогенирование дигалогеналканов:
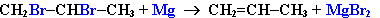
|
Применение
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Алкилированием алкенов добывают насыщенные углеводороды, используемые в качестве моторного топлива.
Этилен (этен) Н2С=СН2 используется для получения полиэтилена, политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Этилен ускоряет созревание некоторых плодов, для чего его вводят в атмосферу хранилищ, где находятся недозрелые овощи и фрукты. Этилен также предотвращает преждевременный сброс плодов растениями в теплицах.
Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров.
Изобутилен (2-метилпропен) Н2С=С(СН3)2 применяется в производстве синтетического каучука.
Вопросы для контроля
1. Какие углеводороды называются алкенами?
2. Изомерия алкенов.
3. Понятие sp2-гибридизации электронных орбиталей атома углерода.
4. Способы получения этиленовых углеводородов.
5. Химические свойства алкенов.
Домашнее задание: [1] с. 43-59 упражнения 1-6 с.48; 1-8 с.54.
Литература:
1.Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005
2. Еремин В.В., Кузьменко Н.Е., Лунин В.В., Дроздов А.А.,Теренин В.И. Химия. 10 класс. Профильный уровень. - М.: Дрофа, 2012.
3. Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2010